批准日期: 2016年10月21日;公司:Merck
为治疗:预防艰难梭菌感染复发
http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/761046s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用ZINPLAVA所需所有资料。请参阅ZINPLAVA完整处方资料。
ZINPLAVA™(bezlotoxumab)注射液,为静脉使用
美国初始批准:2016
适应证和用途
ZINPLAVA是一种人单克隆抗体结合至艰难梭菌Clostridium difficile毒素B,适用于减低艰难梭菌感染的复发(CDI)在患者18岁或以上患者正在接受CDI的抗细菌治疗和是处于对CDI复发高风险。(1)
使用的限制:
ZINPLAVA是不适用为CDI的治疗。ZINPLAVA不是一种抗细菌药。ZINPLAVA只应被与CDI的抗细菌治疗结合使用。(1)
剂量和给药方法
●为CDI抗细菌药治疗期间给予ZINPLAVA。(2.1)
● 推荐剂量是单剂量10 mg/kg历时60 分钟静脉输注给予。(2.2)
● 静脉输注前稀释。Administer 通过一个低-蛋白结合0.2微米至5微米在线或添加滤器。对稀释和给药指导见完整处方资料。(2.3)
剂型和规格
注射液:1,000 mg/40 mL(25 mg/mL)溶液在单剂量小瓶。(3)
禁忌证
无。(4)
警告和注意事项
心力衰竭:在两项3期临床试验中有充血性心衰史(CHF) ZINPLAVA-治疗患者报道更常见。在有CHF史患者,ZINPLAVA应保留当获益胜过风险时使用。(5.1)
不良反应
最常见不良反应(报道在≥4%患者)包括恶心,发热,和头痛。(6.1)
报告怀疑不良反应,联系Merck Sharp & Dohme Corp., Merck & Co.,Inc的一个子公司,电话1-877¬888-4231或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
完整处方资料
1 适应证和用途
ZINPLAVA™是适用于在18岁或以上正在接受CDI的抗细菌治疗和是处于对CDI复发高风险患者中减低艰难梭菌感染的复发(CDI)。
使用的限制:
ZINPLAVA是不适用对CDI的治疗。ZINPLAVA不是一种抗细菌药。ZINPLAVA应仅被在与CDI的抗细菌治疗结合使用。[见剂量和给药方法(2.1).]
2 剂量和给药方法
2.1 重要给药指导
对CDI抗细菌药治疗期间给予ZINPLAVA。
2.2 在成年中给药建议
ZINPLAVA的推荐剂量是单剂量10 mg/kg历时60分钟静脉输注给药。尚未在有CDI患者中研究ZINPLAVA重复给药的安全性和疗效。
2.3 制备和给药
稀释溶液的制备
● ZINPLAVA静脉输注前必须被稀释。
● 从冰箱贮藏取出小瓶后立即制备稀释的溶液,或稀释溶液的制备前小瓶可避光保护在室温贮藏共至24小时。
● 稀释前观察小瓶内容物有无变色和颗粒物质。ZINPLAVA是一种透明至中度乳白色,无色至浅黄色的溶液。如溶液是变色或含可见颗粒不要使用小瓶。
● 不要摇晃小瓶。
● 根据患者体重(kg数)从小瓶抽吸需要的容积和转移至一个含或0.9%氯化钠注射液,USP或5%葡萄糖注射液,USP至静脉袋以制备有最终浓度范围从1 mg/mL至10 mg/mL的稀释溶液。 通过轻轻倒置混合稀释溶液。不要摇晃。
● 遗弃各小瓶和所有未使用的内容物。
稀释溶液的贮存
● 产品不含防腐剂。ZINPLAVA的稀释溶液可被贮存在或室温共至16小时或冰箱下在2°C至8°C(36°F至46°F)共至24小时。如冰箱,用前让静脉袋至室温。
● 这些时间限制包括至输注期间静脉袋中输注溶液的贮存。
● 不要冻结稀释溶液。
给药
● 稀释溶液作为一个历时60分钟静脉输注给予使用一个无菌,无致热原,底蛋白结合0.2微米至5微米在线或加载滤器。
● 稀释溶液可通过一个中央线或外周导管输注。不要作为一个静脉推注或丸注给予ZINPLAVA。
●不要通过相同输注线同时地共-给予其他药物。
3 剂型和规格
注射液:1,000 mg/40 mL(25 mg/mL)透明至中度乳光,无色至浅黄色溶液在一个单剂量小瓶。
4 禁忌证
无。
5 警告和注意事项
5.1 心力衰竭
在两项3期临床试验中在ZINPLAVA-治疗患者与安慰剂-治疗患者比较心力衰竭被报道更常见。这些不良反应发生主要地在患有充血性心力衰竭(CHF)患者。在12周研究阶段期间ZINPLAVA-治疗患者在有CHF史患者,12.7%(15/118)和安慰剂-治疗患者4.8%(5/104)有心力衰竭的严重不良反应[见不良反应(6.1)]。此外,在12周研究阶段有CHF史患者,ZINPLAVA-治疗患者,19.5%(23/118)比安慰剂-治疗患者,12.5%(13/104)有更多死亡。死亡的原因变化和包括心脏衰竭,感染,和呼吸衰竭。
在有CHF史患者中,ZINPLAVA应保留当获益胜过风险时使用。
6 不良反应
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在两项安慰剂-对照, 3期试验(试验1 n= 390和试验2 n= 396)评价ZINPLAVA的安全性。患者接受ZINPLAVA的单次10 mg/kg静脉输注和同时对CDI(SoC)标准医护抗细菌药(甲硝唑[metronidazole],万古霉素[vancomycin]或非达霉素[fidaxomicin])。描述在对合并3期试验786例患者人群给予ZINPLAVA后头4周内被报道的不良反应。接受ZINPLAVA患者的中位年龄为65岁(范围18至100),50%为年龄65岁或以上,56%为女性,和83%为白种人。
用ZINPLAVA治疗后最常见不良反应(报道在≥4%的患者输注的头4周内和有一个频数大于安慰剂)为恶心,发热,和头痛(见表1)。
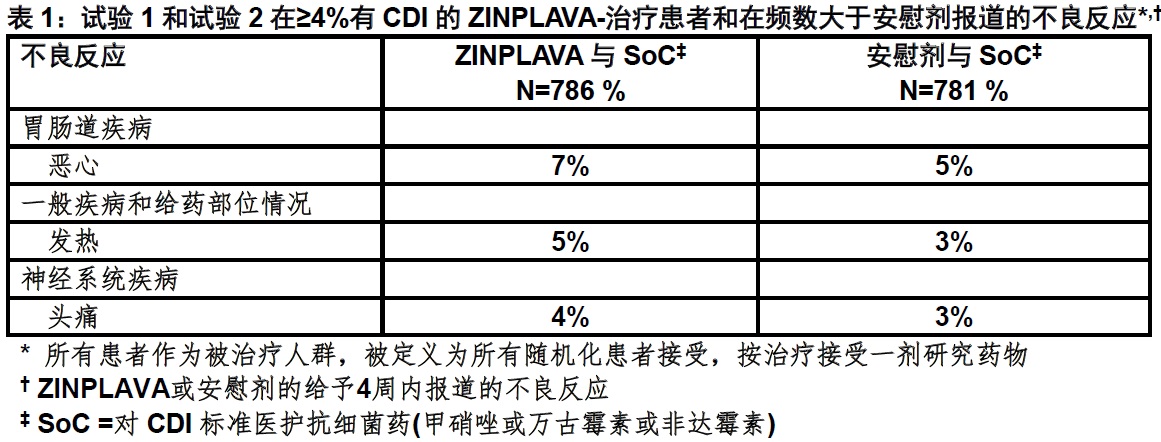
ZINPLAVA-治疗患者中29%和33%安慰剂-治疗患者报道输注后12周内发生严重的不良反应。在2.3%的ZINPLAVA-治疗患者和1.0%的安慰剂-治疗患者报道心衰为严重的不良反应[见警告和注意事项(5.1)]。
一例患者由于输注开始后30分钟发生室性心动过速心律不齐终止ZINPLAVA输注。
在12周随访阶段期间ZINPLAVA-治疗患者和安慰剂-治疗患者死亡率分别为7.1%和7.6%。
输注相关反应
总体而言,10%的ZINPLAVA-治疗患者在当天f,或该天后经受一次或更多输注特异性不良反应,与输注安慰剂-治疗患者8%比较。接受ZINPLAVA中≥0.5%的患者报道的输注特异性不良反应和在频数大于安慰剂为恶心(3%),疲乏(1%),发热(1%),眩晕(1%),头痛(2%),呼吸困难(1%)和高血压(1%)。这些患者中,78%和20%患者分别经受轻度和中度不良反应。这些反应在开始后24小时解决。
6.2 免疫原性
如同所有治疗性蛋白,给予ZINPLAVA后有对免疫原性潜能。抗体形成的检测是高度依赖于分析的灵敏度和特异性,此外,在一种分析观测抗体阳性的发生率(包括中和抗体)可能受几种因素影响包括分析方法学,样品处置,采样时机,同时药物,和所患疾病。因这些理由,在以下描述研究中对bezlotoxumab抗体的发生率的比较与在其他研究中或对其他产品抗体的发生率可能是误导。
在试验1和试验2中ZINPLAVA治疗后,710例对治疗-出现抗-bezlotoxumab抗体可评价的患者无测试阳性。
7 药物相互作用
因为ZINPLAVA是通过降解代谢被消除,预计无代谢性药物-药物相互作用[见临床药理学(12.3)]。
8 特殊人群中使用
8.1 妊娠
风险总结
在妊娠妇女中未曽用ZINPLAVA进行适当和对照良好研究。未曽用bezlotoxumab进行动物生殖和发育研究。
不知道对适应证人群重大出生缺陷和流产的背景风险;但是,在美国一般人群重大出生缺陷的背景风险是2-4%和临床上认可妊娠流产是15-20%。
8.2 哺乳
风险总结
没有有关bezlotoxumab在人乳中存在,对哺乳喂养婴儿影响,或对乳汁生成影响的资料。
哺乳喂养的发育和健康获益应与母亲对ZINPLAVA临床需求和对哺乳儿童来自ZINPLAVA或来自潜在母亲情况任何潜在不良效应一并考虑。
8.4 儿童使用
尚未确定低于18岁患者中ZINPLAVA的安全性和疗效。
8.5 老年人使用
用ZINPLAVA治疗786例患者中,50%是65岁和以上,和27%是75岁和以上。这些受试者和较年轻受试者间未观察到在安全性和疗效中总体差别[见临床研究(14)]。对≥65岁患者无需剂量调整[见临床药理学(12.3)]。
10 药物过量
没有用ZINPLAVA过量的临床经验。在过量病例中,患者应被密切监视不良反应的体征和症状,和应开始适当对症治疗。
11 一般描述
Bezlotoxumab是一种人单克隆抗体它结合至艰难梭菌毒素B和中和它的效应。Bezlotoxumab 是一个IgG1免疫球蛋白与一个近似分子量148.2 kDa。
ZINPLAVA(bezlotoxumab)注射液是一种无菌,无防腐剂,清澈至中度地乳光,无色至浅黄色溶液为静脉输注需要稀释。产品在一个50 mL小瓶内提供其中含1000 mg的bezlotoxumab在40 mL溶液中。每mL溶液含bezlotoxumab(25 mg),柠檬酸一水合物(0.8 mg),二亚乙基三胺五乙酸(0.0078 mg),聚山梨醇80(0.25 mg),氯化钠(8.77 mg),柠檬酸钠二水合物(4.75 mg),和注射用水,USP。小瓶可能含氢氧化钠以调节pH至6.0。
12 临床药理学
12.1 作用机制
ZINPLAVA(bezlotoxumab)是一种人单克隆抗体结合至艰难梭菌毒素B和中和其效应[见微生物学(12.4)]。
12.3 药代动力学
在两项3期试验(试验1和试验2)在1515例CDI患者中研究Bezlotoxumab的药代动力学。根据一项群体PK分析,bezlotoxumab的清除率几何均数(%CV)为0.317 L/day(41%),与一个分布容积均数7.33 L(16%),和消除半衰期(t½)约19天(28%)。在有CDI患者中单次静脉剂量10 mg/kg bezlotoxumab后,几何均数AUC0-INF和Cmax分别为53000 µg·h/mL和185 µg/mL。Bezlotoxumab的清除率随体重增加;所造成的暴露差别通过基于体重给药适当地解决。Bezlotoxumab是通过降解代谢被消除。
特异性人群
性别,种族,民族,和共-患条件
以下因子对bezlotoxumab暴露无临床意义的影响:性别,种族,民族,和存在共-患条件。
有肾受损患者
在有轻度(eGFR 60 to <90 mL/min/1.73 m2),中度(eGFR 30 to <60 mL/min/1.73 m2),或严重(eGFR 15 to <30 mL/min/1.73 m2)肾受损,或有肾病终末期(eGFR <15 mL/min/1.73 m2)患者,当与有正常(eGFR ≥90 mL/min/1.73 m2)肾功能患者比较时评价肾受损对bezlotoxumab药代动力学的影响。未发现有肾受损患者和有正常肾功能患者间bezlotoxumab的暴露临床意义差别。
有肝受损患者
在有肝受损患者(被定义为有以下两种或更多:[1] 白蛋白≤3.1 g/dL;[2] ALT ≥2 × ULN;[3] 总胆红素≥1.3× ULN;或[4]轻度,中度或严重肝病如被Charlson 共-患病指数)报道,当与有正常肝功能患者比较评价肝受损对bezlotoxumab药代动力学的影响。未发现有肝受损患者和有正常肝功能患者间bezlotoxumab暴露临床意义的差别。
老年患者
在范围从18至100岁患者中评价年龄对bezlotoxumab药代动力学的影响。未发现65岁患者和以上以及65岁以下患者间bezlotoxumab暴露临床意义的差别。
药物相互作用研究
因为bezlotoxumab通过降解代谢被消除,预计无代谢性药物-药物相互作用。
12.4 微生物学
作用机制
Bezlotoxumab是一种人单克隆抗体结合艰难梭菌毒素B有一个平衡解离常数(Kd) f <1×10-9M。Bezlotoxumab抑制毒素B的结合和预防它对哺乳动物细胞的作用。Bezlotoxumab不结合至艰难梭菌毒素A。
在体外活性
Bezlotoxumab结合至毒素B上一个表位,被报道是跨越艰难梭菌株保守的,尽管的确存在表位内氨基酸序列变异。在用Vero细胞或Caco-2细胞基于细胞分析体外研究,提示bezlotoxumab中和毒素B的毒性作用。.
13.1 癌发生,突变发生,生育力受损
未进行研究测试bezlotoxumab对致癌性或遗传毒性的潜能。
未曽用bezlotoxumab进行生育力研究。
14 临床研究
在两项随机化,双盲,安慰剂-对照,多中心, 3期试验(试验1和试验2)在接受对CDI抗细菌药的治疗标准医护(SoC)患者中研究ZINPLAVA的安全性和疗效。随机化是按在纳入研究时间SoC(甲硝唑,万古霉素,或非达霉素)和住院状态(住院患者相比门诊患者)分层.
被纳入患者是18岁或以上和有一个CDI确诊,它被定义为腹泻(3或更多松软便运动排便在24或更少小时)和来自研究纳入前多于7天采集的粪便样品对产毒艰难梭菌粪便测试阳性。排除如对CDI计划手术患者,或如他们有不能控制的腹泻疾病。患者接受一个10-天14-天疗程的口服SoC和一个SoC疗程期间的单次输注ZINPLAVA或安慰剂给予。用口服万古霉素或口服非达霉素患者可能还已接受静脉甲硝唑。SoC的选择由医疗保健提供者决定。ZINPLAVA或安慰剂的输注的天相对于SoC的开始范围从SoC的开始前那天至SoC开始后14天有中位数为 SoC的第3天。
在试验1中,403例患者被随机化接受ZINPLAVA和404例患者被随机化接受安慰剂。在试验2中,407例受试者被随机化接受 ZINPLAVA和399例患者被随机化接受安慰剂。完全分析集(FAS)是所有随机化受试者发一个子集与排除以下:(i) 不接受研究药物的输注;(ii) 没有对产毒艰难梭菌局部粪便测试阳性;(iii) 输注1天窗内不接受方案定义的标准医护治疗。在FAS和在试验1和试验2中跨越治疗臂1554例患者随机化至ZINPLAVA或安慰剂的基线特征是相似。中位年龄为65岁,85%是白种人,57%是女性,和68%是在患者中。相似比例的患者接受口服甲硝唑(48%)或口服万古霉素(48%)和4%患者接受口服非达霉素作为他们的SoC。
在研究人群中存在以下风险因子伴随一个高风险的CDI复发或CDI-相关不良结局:51%为≥65 岁,39%接受一或更多次全身抗细菌药(12-周随访阶段期间),治疗下事件前6个月内28%有一次或更多CDI事件(治疗下事件前15%有两次或更多事件),21%是免疫低下和在研究纳入时16%存在临床上严重CDI(当被Zar评分≥2定义1)。在22%有阳性基线培养患者被分离超毒性菌株(核糖体027,078或244),其中87%(189/217株)是核糖体027。
患者被评估存在CDI事件的临床治愈,被定义为SoC方案完成后≤14天无腹泻共连续2天。然后对CDI的复发至施用ZINPLAVA或安慰剂12周内评估实现临床治愈患者。CDI复发被定义为存在CDI事件临床治愈后新腹泻事件的发生伴随对产毒艰难梭菌粪便测试阳性。持久的临床反应被定义为存在CDI事件的临床治愈和输注后至12周无CDI复发。表2包含对试验1和试验2结果。
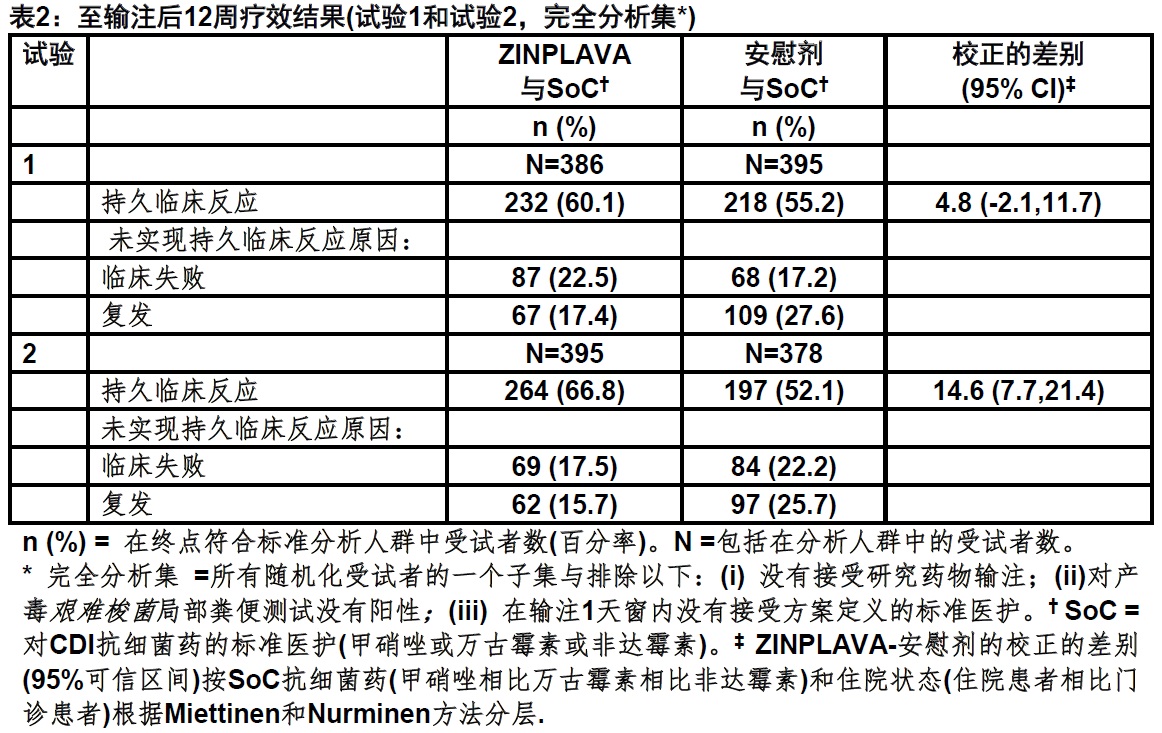
在试验1中,当与安慰剂臂和在试验2比较时在ZINPLAVA臂存在CDI事件的治愈率是较低,安慰剂臂与ZINPLAVA臂比较临床治愈率是较低。在ZINPLAVA和安慰剂臂患者中,没有实现存在CDI事件的临床治愈(一个≤14天SoC方案完成后无腹泻共2连续天)接受一个均数18至19 天的SoC和SoC的完成后有一个均数4另外天的腹泻。另外分析显示至研究药物输注后3周治疗臂间存在CDI事件的临床治愈率是相似。
在试验1和2总体试验人群中处于对CDI复发高风险患者疗效结果(即,患者年龄65岁和以上,在过去6个月有CDI史,免疫受损状态,表现严重CDI,或艰难梭菌核糖体027)疗效结果是恒定一致。
15 参考资料
1. Zar FA, Bakkanagari SR, Moorthi KM, Davis MB. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile-associated diarrhea, stratified by disease severity. Clin Infect Dis 2007;45(3):302-7.
16 如何供应/贮存和处置
ZINPLAVA注射液:是一种无菌,无防腐剂,清晰至中度乳白色,无色至浅黄色溶液和在以下包装规格中供应:
纸盒(NDC 0006-3025-00)含1个单次剂量小瓶ZINPLAVA 1,000 mg/40 mL(25 mg/mL)。
贮存在冰箱中,2ºC至8ºC(36ºF至46ºF)在原始纸盒避光保护。不要冻结。不要摇晃。
17 患者咨询资料
劝告患者阅读FDA-批准的患者说明书(患者资料)。
同时抗细菌治疗
告知患者ZINPLAVA不能代替他们的CDI感染的抗菌治疗。他们必须如指导那样继续他们的抗细菌治疗[见适应证和用途(1)和剂量和给药方法(2.1)]。

