批准日期:2016年12月14日,公司:Pfizer,Inc.
美国FDA批准Eucrisa为湿疹
FDA的药品评价和研究中心(CDER)中药品评价III办公室副主任Amy Egan说:"今天的批准为处理轻度至中度异位性皮炎患者提供另一种治疗选择。"
http://labeling.pfizer.com/ShowLabeling.aspx?id=5331
处方资料重点
这些重点不包括安全和有效使用EUCRISA所需所有资料。请参阅EUCRISA完整处方资料。
EUCRISA™(crisaborole)软膏,2%,为局部使用
美国初次批准:2016
适应证和用途
EUCRISA是一种磷酸二酯酶4抑制剂适用为在2岁和以上患者轻度至中度异位性皮炎[atopic dermatitis]的局部治疗。.(1)
剂量和给药方法
● 对受影响区域应用一薄层每天2次。(2)
● 仅为局部使用。(2)
● 不为眼科,口服或阴道内使用。(2)
剂型和规格
软膏,2%。(3)
禁忌证
已知对crisaborole或制剂的任何组分超敏性。(4)
警告和注意事项
超敏反应:如发生超敏性体征和症状,立即终止EUCRISA和开始适当治疗。(5.1)
不良反应
最常见不良反应发生在≥1%受试者是应用部位疼痛。(6.1)
报告怀疑不良反应,联系Anacor制药电话1-844-4ANACOR [1-844-426-2267]或FDA电话1-800-FDA-1088或www.fda.gov/medwatch.
处方资料
1 适应证和用途
EUCRISA是适用为2岁和以上轻度至中度异位性皮炎患者的局部治疗。
2 剂量和给药方法
对受影响区域应用一薄层的EUCRISA每天2次。
EUCRISA是仅为局部使用和不为眼科,口服,或阴道内使用。
3 剂型和规格
软膏:20 mg的crisaborole每克(2%)白色至米白色软膏。
4 禁忌证
在有已知对crisaborole或制剂任何组分超敏性患者禁忌EUCRISA。[见警告和注意事项(5. 1)]
5 警告和注意事项
5.1 超敏反应
用EUCRISA患者曽发生超敏反应包括接触性荨麻疹。在应用部位或在远处的严重瘙痒,肿胀和红斑事件中应被怀疑超敏性。如发生超敏性体征和症状,立即终止EUCRISA和开始适当治疗。
6 不良反应
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在两项双盲,载体-对照临床试验(试验1和试验2),1012例受试者 2至79岁有轻度至中度异位性皮炎被用EUCRISA治疗每天2次共4周。表1中列出被≥1% 的EUCRISA-治疗受试者报告的不良反应。
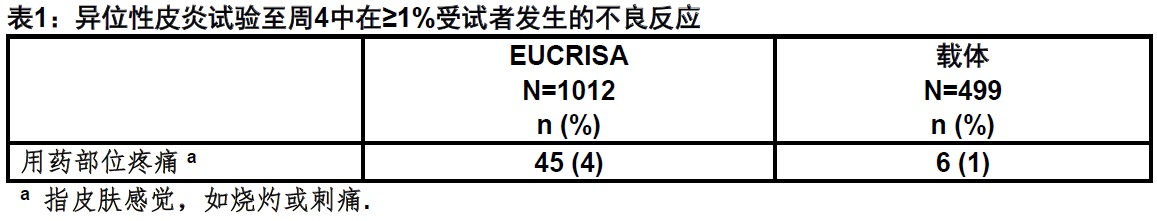
在用EUCRISA治疗受试者较不常见(<1%) 不良反应包括接触性荨麻疹[见警告和注意事项(5.1)].
8 在特殊人群中使用
8.1 妊娠
风险总结
在妊娠妇女中用EUCRISA没有可得到的数据告知对重大出生缺陷和流产药物关联风险。在动物生殖研究中,用口服给予 crisaborole在妊娠大鼠和兔在器官形成期间在剂量直至人最大推荐剂量暴露(MRHD)分别 5和3倍,未观察到不良发育影响[见数据]。
不知道适应证人群重大出生缺陷和流产的背景风险。所有妊娠带有出生缺陷,丢失,或其他不良结局。在美国一般人群中重大出生缺陷的背景风险为2%至4%和临床上认可流产风险为15%至20%。
数据
动物数据
在大鼠和兔口服给予crisaborole后胚胎-胎儿发育评估。在妊娠大鼠在器官形成期间口服剂量直至300 mg/kg/day(在一个AUC 比较基础上MRHD的5 倍) Crisaborole对胎儿不致不良影响。在妊娠大鼠在器官形成阶段时口服用 crisaborole治疗后在剂量直至600 mg/kg/day(在AUC比较的基础上MRHD的18倍)注意到没有治疗相关胎儿畸形。在妊娠大鼠在高剂量600 mg/kg/day产生母体毒性和伴随有胎儿体重减低和延迟骨骼骨化的发现。在妊娠兔在器官形成阶段(在AUC比较基础上MRHD的3倍)口服剂量至最高测试剂量100 mg/kg/day,Crisaborole对胎儿不致不良影响。
在一项围产期发育研究,妊娠大鼠在妊娠和哺乳期间(从妊娠天7至哺乳的天20)被用通过经口灌胃crisaborole治疗在剂量150,300,和600 mg/kg/day。在剂量直至600 mg/kg/day(在AUC比较基础上MRHD的18倍)Crisaborole对胎儿发育没有任何不良影响。在妊娠大鼠在高剂量600 mg/kg/day时产生母体毒性和伴随死胎,幼畜死亡率和幼畜体重减轻的发现。
8.2 哺乳
风险总结
对哺乳喂养妇女局部应用EUCRISA对EUCRISA在人乳汁中的存在,药物对哺乳喂养婴儿的影响或药物对乳汁产生的影响没有可得到的信息。EUCRISA是被全身地吸收。哺乳期间缺乏临床数据阻碍对哺乳喂养婴儿风险一个明确的决定。所以,哺乳喂养对发育和健康获益应被与母亲对EUCRISA的需求和哺乳喂养婴儿来自EUCRISA或来自母亲潜在情况任何潜在的不良影响一并考虑。
8.4 儿童使用
尚未确定年龄2岁和以上轻度至中度异位性皮炎在儿童患者的局部治疗中EUCRISA的安全性和疗效。在这个年龄组EUCRISA的使用被来自两项多中心,随机化,双盲,平行组,载体-对照28-天试验证据支持其中包括1,313例2岁和以上儿童受试者[见不良反应(6.1)和临床研究(14)]。尚未确定在2岁以下年龄儿童患者EUCRISA的安全性和有效性。
8.5 老年人使用
EUCRISA的临床研究没有包括足够数量年龄65和以上受试者不能确定他们反应是否与较年轻受试者不同地反应。
11 一般描述
EUCRISA在基于凡士林含2% crisaborole(w/w),白色至米白色软膏和是为局部使用。活性成分,crisaborole,是一种磷酸二酯酶-4(PDE-4)抑制剂。
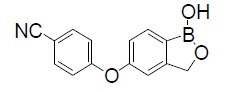
Crisaborole化学上被描述为5-(4-cyanophenoxy)-1,3-dihydro-1-hydroxy-[2,1]-benzoxaborole。经验式为C14H10BNO3和分子量为251.1 g/mol。结构式如下:
Crisaborole药物物质是自由地溶解在常用有机溶剂例如异丙醇和聚乙二醇,和不溶于水。
在一个软膏中每克EUCRISA含20 mg的crisaborole含白凡士林,聚乙二醇,单-和双-甘油酯,石蜡,丁基化羟基甲苯,和乙二胺四乙酸钙二钠。
12 临床药理学
12.1 作用机制
Crisaborole是一个磷酸二酯酶4(PDE-4)抑制剂。PDE-4抑制作用导致增加细胞内环化腺苷一磷酸(cAMP)水平。Crisaborole 发挥其对异位性皮炎的治疗作用的特异性机制尚未很好确定。
12.2 药效动力学
在治疗剂量,EUCRISA软膏预期不延长QTc至任何临床上相关程度。
12.3 药代动力学
吸收
在33例2至17岁有轻度至中度异位性皮炎和一个均数 ± SD 体表面积涉及49 ± 20%(范围27%至92%)儿童受试者中研究EUCRISA的药代动力学(PK)。在这项研究中,受试者应用约3 mg/cm2的EUCRISA软膏(剂量范围约6 g至30 g每次应用)每周2次共8天。
在所有受试者中血浆浓度是可定量的。对crisaborole在天8时,均数 ± SD最高血浆浓度(Cmax)和给药后(AUC0-12)从0至12小时血浆浓度时间曲线下面积分别为127 ± 196 ng/mL和949 ± 1240 ng*h/mL。Crisaborole的全身浓度在天8达到稳态。
根据天8和天1间AUC0-12的比值,对crisaborole的均数积蓄因子为1.9。
分布
根据一项体外研究,crisaborole是97%结合至人血浆蛋白。
消除
代谢
Crisaborole是实质上代谢为无活性代谢物。通过水解形成主要代谢物5-(4-cyanophenoxy)-2-hydroxyl benzylalcohol(代谢物1);这个代谢物被进一步代谢至下游代谢物,其中通过氧化形成5-(4-cyanophenoxy)-2-hydroxyl benzoic acid(代谢物 2),也是主要代谢物。
在上述PK研究评估代谢物1和2的PK和全身浓度在天8时处于或接近稳态。根据在天8和天1间的AUC0-12的比值,对代谢物1和2的均数积蓄因子分别为1.7和6.3。
排泄
代谢物的肾排泄是消除的主要途径。
药物相互作用研究
利用人肝微粒体的体外研究表明在临床使用的条件下,crisaborole和代谢物1预期不抑制细胞色素P450(CYP)1A2,2B6,2C8,2C9,2C19,2D6,和3A4。
对代谢物2的人肝微粒体研究显示它不抑制CYP2C19,2D6,和3A4的活性;是CYP1A2和2B6的弱抑制剂;和CYP2C8和2C9的中度抑制剂。最敏感酶,CYP2C9,在一项临床试验中利用华法林[warfarin]作为CYP2C9底物被进一步研究。这项研究结果显示无药物相互作用的潜能。
在人肝细胞体外研究显示在临床使用条件下,crisaborole和代谢物1和2预期不诱导CYP酶。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在Sprague-Dawley大鼠中一项口服致癌性研究中,口服剂量30,100,和300 mg/kg/day crisaborole被给予大鼠每天1次。注意到在子宫与子宫颈或阴道(联合)一个良性颗粒细胞肿瘤发生率药物-相关增加在300 mg/kg/day crisaborole治疗的雌性大鼠(在一个AUC比较基础上MRHD的2倍)。不知道这个发现的临床相关性。
在CD-1小鼠中一项皮肤致癌性研究中,局部给予2%,5%和7%crisaborole软膏每天1次。在局部给予至7% crisaborole软膏(根据一个AUC比较基础MRHD的2倍)未注意到药物-相关肿瘤发现。
根据两项体外遗传毒性试验(Ames试验和人淋巴细胞染色体畸变试验)和一项体内遗传毒性试验(大鼠微核试验)的结果,未揭示Crisaborole致突变性或致染色体畸变的证据。
在雄性或雌性大鼠早期妊娠前和期间被给予口服剂量直至600 mg/kg/day crisaborole(根据AUC比较基础为MRHD的18倍)未观察到对生育力的影响。
14 临床研究
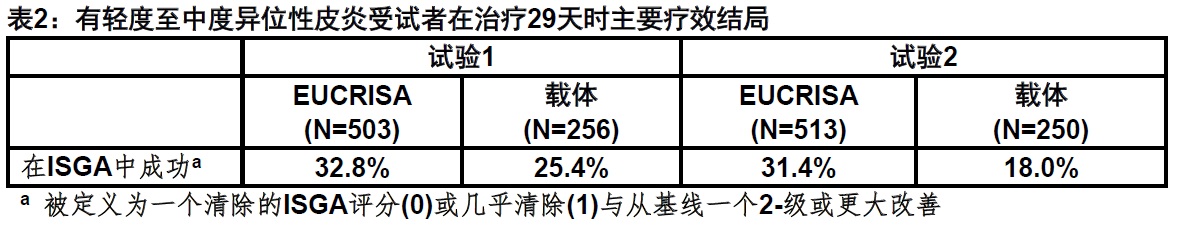
两项多中心,随机化,双盲,平行组,载体-对照试验(试验1和2)治疗总共1522例2至79岁受试者(86.3%受试者为2至17岁)有一个5%至95%可治疗的体表面积。在基线时,38.5%的受试者有一个研究者的静态全面评估[ISGA]评分2(轻度),和61.5%有一个ISGA评分3(中度),异位性皮炎的总体评估中对严重程度评分0至4(红斑,硬化/丘疹形成,和渗出/结痂)。
在两项试验中,受试者2:1被随机化至接受被应用的EUCRISA或载体每天2次共28天。主要疗效终点是在第29天时实现成功受试者的比例,被定义为比较EUCRISA-治疗受试者与载体-治疗受试者一个ISGA清除级别(评分0)或几乎清除(评分1)与从基线一个2-级或更大改善。
表2中总结来自两项试验的疗效结果。
在图1中展示随时间的成功率。
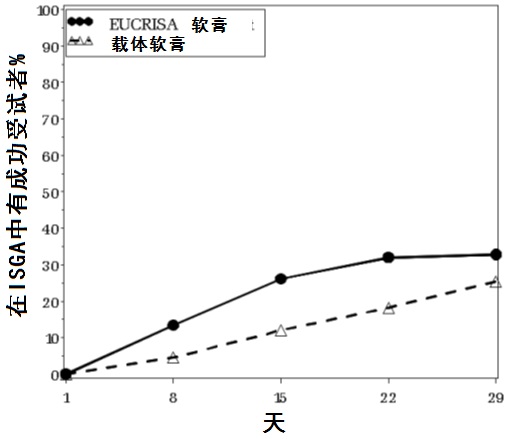
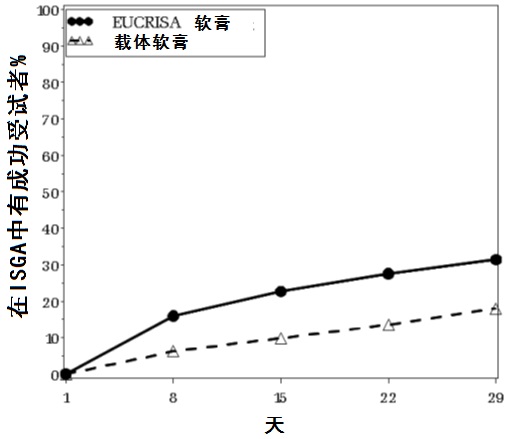
图1:在受试者有轻度至中度异位性皮炎中ISGAa随时间中成功,a 成功被定义为一个清除的ISGA评分清除(0)或几乎清除(1)与从基线2-级或更大改善
16 如何供应/贮存和处置
16.1 如何供应
EUCRISA是一个白色至米白色软膏含2% crisaborole和在60 g和100 g层压管中供应。
60 g管:NDC 55724-211-21
100 g管:NDC 55724-211-11

