批注日期:2017年1月19日:公司:Synergy Pharmaceuticals Inc
FDA的药品评价和研究中心中药品评价药品评价III室主任Julie Beitz,M.D.说:“没有一个药物对患慢性胃肠道疾病的所有患者起作用,” “随新治疗的可供利用,患者和他们的医生可对他们的情况选择最适宜治疗。”
处方资料重点
这些重点不包括安全和有效使用TRULANCE所需所有资料。请参阅TRULANCE完整处方资料。
TRULANCE(plecanatide)片,为口服使用
美国初次批准:2017
适应证和用途
TRULANCE是一种鸟苷酸环化酶-C激动剂适用在成年中为慢性特发性便秘(CIC)的治疗。(1)
剂量和给药方法
TRULANCE的成年推荐剂量是3 mg口服使用每天1次。(2.1)
给药指导(2.2):
●有或无食物服用。
● 对难以吞咽整片患者或用一鼻胃或胃饲管患者,见完整处方资料与对粉碎片和与苹果酱或水给予指导。
剂型和规格
片:3 mg(3)
禁忌证
● 患者低于6岁由于严重性脱水的风险。(4,5.1,8.4)
● 有已知或怀疑机械性胃肠道阻塞患者。4)
警告和注意事项
腹泻:患者可能经受严重的腹泻。如发生严重的腹泻,暂停给药和再水化患者。(5.2)
不良反应
最常见不良反应(≥2%)是腹泻。6.1)
报告怀疑不良反应,联系Synergy Pharmaceuticals电话1-888-869-8869或FDA电话1-800-FDA-1088或www.fda.gov/medwatch.
完整处方资料

1 适应证和用途
TRULANCE是适用在成年中为慢性特发性便秘(CIC)的治疗。
2 剂量和给药方法 。
2.1 推荐剂量
TRULANCE的推荐剂量为3 mg口服每天1次。
2.2 准备和给药指导
●有或无食物服用TRULANCE[见临床药理学(12.3)].
● 如缺失一剂量,跳过缺失剂量和在常规时间服用下一次剂量。不要在相同时间服用两剂量。
● 对每次剂量整吞一片。
● 对有吞咽困难成年患者,TRULANCE片可被粉碎和口服给予或在苹果酱中或与水或与水通过一个鼻咽管或胃饲管。尚未测试混合粉碎的TRULANCE片在其他软食物其他液体。
在苹果酱口服给药:
1. 在一清洁容器,粉碎TRULANCE片至粉和与室温苹果酱一茶匙混合。
2. 立即消耗整片-苹果酱混合物。不要贮存化合物为以后使用。
在水中口服给药:
1. 将TRULANCE片放在一清洁杯中。
2. 倾倒约30 mL室温水至被内。
3. 通过轻轻旋转片和水化合物共至少10秒混合。TRULANCE 片将在水中裂解。
4. 立即吞咽片水混合物的整个内容物。
5. 如片的任何部分残留在杯中,加入另外30 mL水至杯中,旋转至少10秒,和立即吞咽。
6. 不要贮存片-水混合物为以后使用。
通过一个鼻胃或胃饲管与水给药:
1. 放置TRULANC片在一个有30 ml室温水清洁杯中。.
2.通过轻轻片和水混合物共至少15秒。TRULANCE片将在水中裂解。
3. 用用一个适当注射器用30 ml水冲洗鼻胃或胃饲管。
4. 用注射器抽吸混合物和立即通过鼻胃或胃饲管给予。不要保留为将来使用。
5. 如片的任何部分被留在杯中,加入另外30 mL水至杯中,旋转共至少15秒,和用相同注射器,通过鼻胃或胃饲管给予。.
6. 利用相同或一个新鲜注射器,用至少10 mL水冲洗鼻胃或胃饲管。
3 剂型和规格
TRULANCE片:
3 mg:白色至米白色,平坦,圆片在一侧上凹陷有“SP”和另一侧上“3”对3 mg。
4 禁忌证
TRULANCE在以下患者中禁忌:
●低于6岁由于严重性脱水的风险患者[见警告和注意事项(5.1),特殊人群中使用(8.4)]。
●有已知或怀疑机械性胃肠道阻塞患者。
5 警告和注意事项
5.1 在儿童患者中严重性脱水的风险
在低于6岁患者TRULANCE是被禁忌。尚未确定在低于18岁患者中TRULANCE的安全性和有效性。在幼年小鼠(人年龄等同于约1月至低于2岁),plecanatide增加液体分泌至小肠作为鸟苷酸环化酶-C(GC-C)刺激的后果,导致在有些小鼠在头24小时内死亡率,显然由于脱水。由于GC-C增加的小肠表达,低于6岁患者可能比6岁和以上患者更可能发生严重腹泻及其潜在地严重后果。
在6岁至低于18岁患者中避免使用TRULANCE。虽然在较年长的幼年小鼠没有死亡,在较年幼小鼠给予死亡和在儿童患者中缺乏临床安全性和疗效数据,在6岁至低于18岁患者中避免TRULANCE的使用[见禁忌证(4),警告和注意事项(5.2),特殊人群中使用(8.4)]。
5.2 腹泻
在两项安慰剂-对照临床试验中腹泻是最常见不良反应。在0.6%的患者中报道严重腹泻[见不良反应(6.1)]。如发生严重的腹泻,暂停给药和患者再水化。.
6 不良反应
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
来自两项双盲安慰剂-对照临床试验(研究1和研究2)接受安慰剂或3 mg的TRULANCE每天1次共12周,1733例成年有CIC患者反映以下描述安全性数据。TRULANCE和安慰剂组间人口统计指标特征是有可比性[见临床研究(14)]。
最常见不良反应
表1提供在TRULANCE-治疗组报道在至少2%的CIC患者和在一个发生率大于在安慰剂组不良反应的发生率。

腹泻
腹泻报道的病例的多数发生在治疗开始的4周内。在0.6%的TRULANCE-治疗患者报道严重腹泻在与之比较安慰剂-治疗患者为0.3%。严重腹泻被报道发生在治疗头3天内[见警告和注意事项(5.2)].
不良反应导致终止
在4%的TRULANCE-治疗患者和2%的安慰剂-治疗患者发生由于不良反应的终止。最常见不良反应导致终止为腹泻:2%的TRULANCE-治疗患者和0.5%的安慰剂-治疗患者由于腹泻撤出。
较少的常见不良反应
不良反应报道在低于2%的TRULANCE-治疗患者和在一个发生率大于安慰剂为:窦炎,上呼吸道感染,腹胀,胀气,腹部压痛,和肝脏生化测试增高(2例患者有丙氨酸转氨酶(ALT)大于正常上限5至15倍和3例患者有天冬氨酸转氨酶(AST)大于正常上限5倍。
8 特殊人群中使用
8.1 妊娠
风险总结
口服给药后Plecanatide及其活性代谢物被忽略地全身吸收[见临床药理学(12.3)]和母体使用预计不导致胎儿对药物的暴露。在妊娠妇女使用TRULANCE可得到的数据不足以告知对重大出生缺陷和流产任何药物-关联风险。在动物发育研究中,在小鼠和兔中,在器官形成期在剂量远远高于推荐的人剂量时未观察到对胚胎胎儿发育的影响。
不知道在适应证人群中对重大出生缺陷和流产的估算背景风险。所有妊娠有出生缺陷,丢失,或其他不良结局。在美国一般人群,重大出生缺陷和在临床上认可妊娠的估算风险分别是2%至4%和15%至20%。
数据
动物数据
妊娠小鼠和兔在器官形成阶段被给予plecanatide。在小鼠口服剂量至800 mg/kg/day和在兔中250 mg/kg/day没有对胚胎-胎儿发育的证据。在小鼠中在器官形成期至哺乳时口服给予至600 mg/kg/day不产生发育异常或在子代至成熟中对生长,学习和记忆,或生育力影响。
根据60-kg体重,人最大推荐剂量约为0.05 mg/kg/day。在动物中在器官形成期达到有限全身暴露(在兔中给予250 mg/kg/day血浆浓度-时间曲线下面积(AUCt) = 449 ng•h/mL)。给予推荐的临床剂量后在人血浆中不能测量到Plecanatide及其活性代谢物。所以,为评价相对暴露,不应直接地比较动物和人剂量。
8.2 哺乳
风险总结
没有关于plecanatide在人乳汁中的存在,或它对乳汁产生或哺乳喂养婴儿的影响的信息。在动物中没有进行哺乳的研究。口服给药后Plecanatide及其活性代谢物全身地吸收是可以忽略不计的[见临床药理学(12.3)]。
不知道plecanatide被成年可忽略不计的全身吸收是否导致对哺乳喂养婴儿在临床上相关暴露。哺乳喂养婴儿对plecanatide暴露有对严重不良作用潜能[见在特殊人群中使用(8.4)]。哺乳喂养的发育和健康获益应与母亲对TRULANCE的临床需求和哺乳喂养婴儿来自TRULANCE或来自母体所患情况任何潜在不良效应一并考虑。
8.4 儿童使用
在儿童患者中低于6岁TRULANCE被禁忌。在6岁至低于18岁患者中避免使用TRULANCE[见禁忌证(4),警告和注意事项(5.1)]。尚未确定低于18岁患者中TRULANCE的安全性和有效性。
在非临床研究中,在幼小鼠(人龄等同于约1个月至低于2岁)口服给予plecanatide后,死亡发生在24小时内如下面在幼年动物毒性数据描述。因为小肠GC-C的增加的表达,低于6岁患者可能比6岁和以上患者更可能发生腹泻及其潜在的严重后果。在低于6岁患者中禁忌TRULANCE。在幼年幼小鼠中给予死亡和在儿童患者中缺乏临床安全性和疗效数据,在6岁至低于18岁患者中避免TRULANCE的使用。
幼年动物毒性数据
单次口服剂量plecanatide在0.5 mg/kg和10 mg/kg在幼幼年小鼠分别在产后天7和14致死亡率(人龄等同于约1个月至小于2岁)。在幼年小鼠单次剂量plecanatide后对产后天14(人龄等同于约小于2岁)观察到小肠内容物重量治疗-相关增加,与小肠肠腔内液体增加一致。虽然,根据一个60-kg体重,推荐的人剂量为约0.05 mg/kg/day,在成年血浆中plecanatide及其活性代谢物是不能测量到的,而在幼年小鼠毒性研究显示全身吸收。对评价相对暴露,不应直接地比较动物和人剂量。
8.5 老年人使用
TRULANCE的临床研究没有包括足够数量的年龄65和以上患者以确定他们反应是否不同于18岁至低于65岁患者。在TRULANCE临床试验2601例受试者中,273(10%)为65岁和以上,和47(2%)为75岁和以上。
一般说来,对对一位老年患者剂量选择应谨慎,反映减低的肝,肾,或心功能,和同时疾病或其他药物治疗较大频数。
11 一般描述
TRULANCE(plecanatide)是一种鸟苷酸环化酶-C(GC-C)激动剂。Plecanatide是一个16个氨基酸多肽有以下化学名:L-Leucine,L-asparaginyl-L-α-aspartyl-L-α-glutamyl-L-cysteinyl-L-α- glutamyl-L-leucyl-L-cysteinyl-L-valyl-L-asparaginyl-L-valyl-L-alanyl-L-cysteinyl-L-threonylglycyl-L-cysteinyl-,cyclic(4→12),(7→15)-bis(disulfide).
Plecanatide的分子式为C65H104N18O26S4和分子量为1682道尔顿。对plecanatide氨基酸序列显示如下:
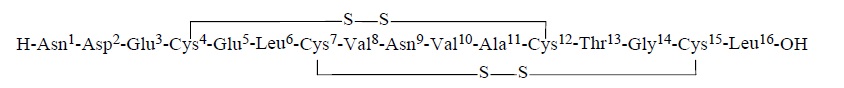
实线显示双硫桥连接。
Plecanatide是一种无定形,白色至灰白色粉。图溶于水。TRULANCE片是以3 mg片供应为口服给药。无活性成分是硬脂酸镁和微晶纤维素。
12 临床药理学
12.1 作用机制
Plecanatide是结构上与人尿鸟苷蛋白[uroguanylin]相关,和相似于尿鸟苷蛋白,plecanatide 功能作为一个鸟苷酸环化酶-C(GC-C)激动剂。Plecanatide及其活性代谢物两者结合至GC-C和局部地作用于肠上皮的腔表面。GC-C的活化导致细胞内和细胞外两者环鸟苷酸(cGMP)浓度的增加。细胞内cGMP的升高刺激氯化物和碳酸氢盐得到分泌至小肠腔,主要地通过囊性纤维化跨膜传导调节剂[cystic fibrosis transmembrane conductance regulator(CFTR)]离子通道的活化,导致小肠液增加和加速通过。在动物模型中,plecanatide曽b欸显示增加液体分泌至胃肠(GI)道,加速小肠通过,和引起粪便粘稠度变化。
在内脏痛的动物模型中,plecanatide减低异常肌肉收缩,小肠疼痛的一种测量。尚未研究其机制。
12.2 药效动力学
食物效应
受试者接受或低-脂肪,低热量(LF-LC)餐或一种高脂肪,高热量(HF-HC)餐报道比空腹受试者更松软粪直至单次剂量TRULANCE 9 mg(3倍推荐剂量)后24小时。在临床研究中,TRULANCE被给予有或无食物[见剂量和给药方法(2.2)]。
12.3 药代动力学
吸收
口服给药后Plecanatide是有可忽略不计全身生物利用度最小地被吸收。一个口服TRULANCE剂量3 mg后血浆中plecanatide及其活性代谢物的浓度是低于定量低限。所以,不能计算标准药代动力学参数例如AUC,最高浓度(Cmax),和半衰期(t½)。
食物效应
在一项交叉研究中,24例健康受试者被给予一次单次剂量的TRULANCE 9 mg(3倍推荐剂量)在3种不同状态:空腹;一个低-脂肪后,低热量餐(LF-LC;约350卡路里:17%来自脂肪,66% 来自碳水化合物,和17%来自蛋白质);和一个高-脂肪,高-热量餐后(HF-HC;约1000卡路里:60%来自脂肪,25%来自碳水化合物,和15%来自蛋白质)。在一例受试者(空腹态)在给药后0.5和1小时检测到Plecanatide。对所有其他时间点和对其他所有受试者Plecanatide浓度 是低于定量的低限。在任何受试者不没有检测到活性代谢物。
分布
临床上相关口服剂量后给予的plecanatide浓度是不可测量的,plecanatide被预计最小地分布在组织。口服plecanatide被局限至GI道在那里它发挥它作为一个GC-C激动剂的效应与可忽略不计的全身暴露。Plecanatide表现出很小至无结合至人血清白蛋白或人α-1-酸性糖蛋白。
消除
代谢
Plecanatide是在GI道中被代谢至一个活性代谢物通过丢失末端亮氨酸部分。Plecanatide和代谢物两者在小肠腔被蛋白水解地降解为较小的多肽和天然存在的氨基酸。
排泄
在人中未曽进行排泄研究。在推荐临床剂量给予后在血浆中不能检测到Plecanatide及其活性代谢物。
药物相互作用研究
Plecanatide及其活性代谢物不抑制细胞色素P450(CYP)酶2C9和3A4,和它们在体外不诱导CYP3A4。
Plecanatide及其活性代谢物在体外不是转运蛋白P-糖蛋白(P-gp)或乳腺癌耐药蛋白(BCRP)底物或抑制剂。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
癌发生
在小鼠和大鼠中2年致癌性研究评价plecanatide的致癌性潜能。在小鼠中Plecanatide在口服剂量直至90 mg/kg/day或在大鼠中在口服剂量至100 mg/kg/day不是致肿瘤性。在动物中在测试剂量水平实现对plecanatide有限的全身暴露,而在人中无可检测到的暴露。所以,动物和人剂量不应被直接比较相对暴露。
突变发生
在体外细菌回复突变(Ames)试验,体外小鼠淋巴瘤突变分析,或体内小鼠骨髓微核试验Plecanatide没有遗传毒性。
生育力受损
在雄性或雌性小鼠在口服剂量至600 mg/kg/day Plecanatide对生育力或生殖功能无影响。
14 临床研究
在成年患者两项12-周,双盲,安慰剂对照,随机化,多中心临床研究(研究1和研究2)确定TRULANCE对CIC症状处理的疗效。在意向治疗(ITT)人群,总共905例患者(研究1)和870例患者(研究2)被随机化1:1至或安慰剂或TRULANCE 3 mg,每天1次。在临床研究中,研究药物被给予不管食物摄取。对这些研究人口统计指标包括一个总体均数年龄45岁(范围 18至80 岁),80%女性,72%白种人,和24%黑种人。
对研究合格,筛选访问前患者被要求符合修饰的Rome III标准至少共3个月,诊断前有症状开始共至少6个月。Rome III标准被修饰要求患者报告每周排便少于3次,罕见地有一次松软便没有使用泻药,不使用手动操作促进排便,和不符合对IBS-C标准。此外,患者被要求报告胰以下症状的至少两个:
● 在至少5%排便期间用力
● 在排便中至少有25%的块状或硬便
● 感觉不完全排空至少25%的排便
● 感觉肛门直肠阻塞/阻塞至少25%的排便
在筛选阶段时符合这些标准患者还要求至少2周显示以下:
● 低于3次完全自发性肠道运动(CSBMs)(一个CSBM是一种SBM伴随完全排空的感觉)在两周的各周
● Bristol粪便形式评分(BSFS)25%的自发性肠道运动(SBMs)少于6或7(一个SBM是没有使用泻药中发生在一次肠运动)
● 以下三种之一:
o 在至少25%排便中BSFS 1或2
o 当报告肠道运动时至少25%天被记录一个用力值[A straining value]
o 至少25%的肠运动导致不完全排空的感觉
利用一个反应者分析和在CSBM和SBM终点从基线的变化评估TRULANCE的疗效。利用被患者在电子日记中每日基础提供信息评估疗效。从基线
一个反应者是被定义为一例患者在给定周有至少3次CSBMs和在12周的治疗阶段至少9周从在相同周基线和研究的最后4周至少3周至少增加1次CSBM。在表2中显示反应者率。
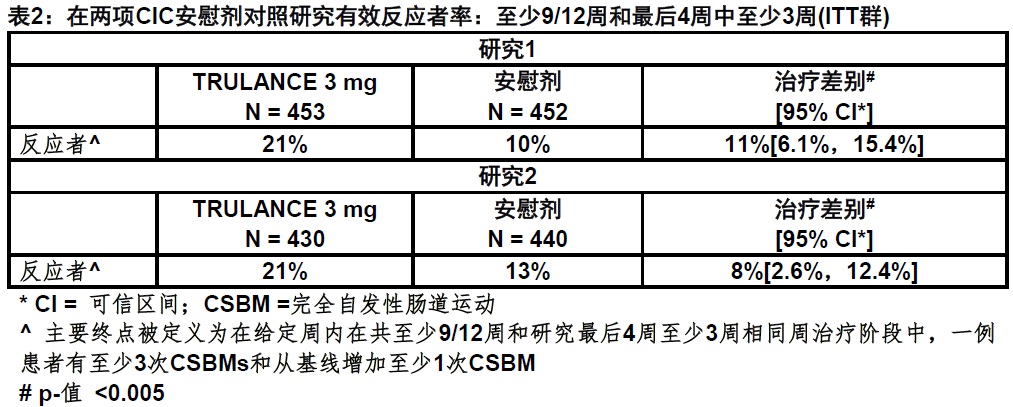
在两项研究中,在早至周1都见到CSBMs/周频数改善与改善维持至周12。TRULANCE组和安慰剂组间差别从基线至周12 CSBMs/周频数的均数变化是约1.1 CSBMs/周。
历时12周治疗阶段期间,在TRULANCE组当与安慰剂比较时,在排粪便频数(CSBMs/周和SBMs/周数)观察到改善和/或粪便粘稠度(当通过BSFS测量),和/或与肠道运动尽力[straining]量(推出时间量或通过粪便机体的努力)。
研究药物治疗阶段的完成后,患者在每天日记中继续记录数据共一个2周治疗后阶段。在这段时间期间,TRULANCE-治疗患者一般地返回至对这些研究终点的基线。
在研究1和2中,TRULANCE 6 mg 每天1次的一个第三随机化治疗臂没有显示附加治疗获益和比TRULANCE 3 mg每天1次有不良反应一个更大的发生率。所以,不推荐TRULANCE 6 mg 每天1次[见剂量和给药方法(2.1)]。
16 如何供应/贮存和处置
TRULANCE片被包装在一个儿童安全包铝箔单位剂量吸塑30片包装或在一个白色,不透明,高密度聚乙烯圆瓶有一个螺旋-顶部聚丙烯防儿童-盖和热活化诱导密封。每瓶容器-系统还含 干燥剂和聚酯线圈。
TRULANCE 3 mg片是白色至米白色,平坦和圆形,在一侧凹陷有“SP” 和在另一侧对3 mg “3” 和供应为::

贮存在室温,20至25°C(68至77°F);外出允许至15至30°C(59至86°F) [见USP控制室温]。
保存TRULANCE在一个干燥部位。避潮保护。对瓶,保存TRULANCE在原始瓶内。不应将干燥剂从瓶中取出。不要分装或重新包装。.
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(用药指导)。
建议患者:
腹泻
如他们经受严重腹泻停止TRULANCE和联系他们的卫生保健提供者[见警告和注意事项(5.2)]。
意外摄入
在儿童中意味摄入TRULANCE,尤其在低于6岁儿童,可能导致严重腹泻和脱水。指导患者 采取步骤安全地驻藏TRULANCE和在儿童不能达到地方和遗弃未使用TRULANCE [见禁忌证(4),警告和注意事项(5.2)]。
给药和处置指导
● 服用TRULANCE每天1次有或无食物[见剂量和给药方法(2.2)]。
● 如缺失一剂,跳过缺失剂量和服用在常规时间的下一剂量。在相同时间不要服用两剂量。
● 整吞TRULANCE片。
● 如成年患者有吞咽困难,TRULANCE片可被粉碎和在或苹果酱中或与水,或通过鼻胃或胃饲管与水口服给予,如在用药指导中描述。
● 保持TRULANCE在干燥部位。防潮保护。对瓶,保持TRULANCE在原始瓶中。不要将干燥剂从瓶中取出。不要分装或重新包装。在打开后取出和遗弃聚酯线圈。保持瓶严密地关闭[见如何供应/贮存和处置(16)]。

