批准日期: 2017年3月21日:公司: Newron Pharmaceuticals S.p.A.
FDA的药品评价和研究中心中的神经学产品部副主任Eric Bastings,M.D.说:“帕金森是一种持续强烈不停的[relentless]疾病没有一种治愈,” “我们致力于帮助使患者得到对帕金森病另外治疗。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2017/207145lbl.pdf
处方资料重点
这些重点不包括安全和有效使用XADAGO需所有资料。请参阅XADAGO完整处方资料。
XADAGO(safinamide)片,为口服使用
美国初次批准:2017
适应证和用途
XADAGO是一种单胺氧化酶型B(MAO-B)抑制剂适用为对左旋多巴[levodopa]/卡比多巴[carbidopa]在有帕金森病(PD)经受“不用药[off]”发作患者辅助治疗(1)
使用的限制:XADAGO未曽显示作为单药治疗对PD治疗的疗效。.
剂量和给药方法
● 开始用50 mg给药每天口服1次在该天的相同时间;在两周后,剂量可能被增加至100 mg每天1次,根据个体需要和耐受性(2.1)
● 肝受损:不要超过50 mg每天1次在患者有中度肝受损;在有严重的肝受损患者中禁忌(2.2,4)
剂型和规格
片:50 mg和100 mg(3)
禁忌证
在以下患者中禁忌XADAGO:
● 同时使用以下药物:
o 其他单胺氧化酶抑制剂或是单胺氧化酶的强抑制剂其他药物(如,利奈唑胺[linezolid])(4,7.1)
o 阿片类药物(如,曲马多[tramadol],哌替啶[meperidine]和相关衍生物);选择性去甲肾上腺素再摄取抑制剂;三-或四-环或三唑吡啶抗抑郁药;环苯扎林[cyclobenzaprine];苯哌啶醋酸甲酯[methylphenidate],安非他明[amphetamine],和它们的衍生物;圣约翰草[St. John’s wort](4,7.2,7.3,7.5)
o 右美沙芬[Dextromethorphan](4,7.4)
●对safinamide超敏性史。(4)
● 严重的肝受损(Child-Pugh C:10-15)(4)
警告和注意事项
●可能致或加重高血压(5.1)
● 当与MAO抑制剂,抗抑郁剂,或阿片类药物使用可能致5-羟色胺综合证。(5.2)
● 白天生活的活动期间可能致入睡。(5.3)
● 可能致或加重运动功能障碍;考虑左旋多巴剂量减低(5.4)
● 可能致幻觉和精神病行为(5.5)
● 可能致问题有控制冲动/强迫性行为(5.6)
● 可能致戒断出现高热症[withdrawal-emergent hyperpyrexia]和混乱[confusion[(5.7)
不良反应
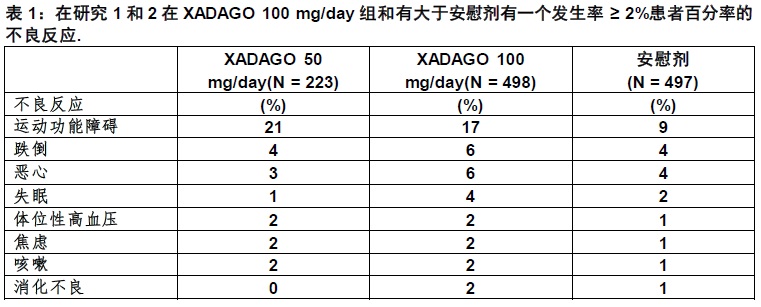
最常不良反应(发生率用XADAGO 100 mg/day至少2%大于安慰剂)为运动功能障碍,跌倒,恶心,和失眠(6.1)
报告怀疑不良反应,联系US WorldMeds,LLC,电话1-888-492-3246或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
● 选择性5-羟色胺再摄取抑制剂:监视患者对5-羟色胺综合证(7.3)
● 交感神经药物:监视患者对高血压(7.5)
● 酪胺:严重的高血压的风险(7.6)
● 乳癌耐药蛋白的底物(BCRP): BCRP底物血浆浓度中潜在增加(7.7)
在特殊人群中使用
妊娠:根据动物数据,可能致胎儿危害。(8.1).
完整处方资料
1 适应证和用途
XADAGO是适用为对左旋多巴/卡比多巴在有帕金森病(PD)经受 “没有”发作患者中的辅助治疗。
限制使用
XADAGO未知被显示作为单药治疗对PD治疗的疗效。
2 剂量和给药方法
2.1 给药资料
XADAGO的推荐开始剂量是50 mg给药每天口服1次(在该天相同时间)不考虑餐,在两周后,剂量可能被增加至100 mg每天1次,根据个体需要和耐受性。
XADAGO的每天剂量高于100 mg未曽显示提供附加获益,和较高剂量增加不良反应风险。XADAGO仅曽与左旋多巴/卡比多巴联用被显示疗效[见适应证和用途(1)]。
如果一个剂量被缺失,应在下一天的相同时间服用下一次剂量。
停止前XADAGO 100 mg应被滴定调整减低剂量至50 mg共一周[见警告和注意事项(5.7)].
2.2 在有肝受损患者中给药
有中度肝受损患者(Child-Pugh B:7-9),的最大推荐剂量XADAGO是50 mg每天口服1次。XADAGO在有严重的肝受损患者禁忌(Child-Pugh C:10-15)[见在特殊人群中使用(8.6)和临床药理学(12.3)]。如一例患者用50 mg XADAGO从中度进展严重的肝受损,终止XADAGO。
3 剂型和规格
● 50 mg 片:橙色至铜有金属光泽,圆形,一侧双凹形凹陷有 “50”。
● 100 mg 片:橙色至铜有金属光泽,圆形,一侧双凹形凹陷有“100”。
4 禁忌证
在以下患者禁忌XADAGO:
●其他药物在单胺氧化酶抑制剂(MAOI)类或其他药物是单胺氧化酶的强效抑制剂,包括利奈唑胺的同时使用。组合可能导致血压增加,包括高血压危象[见警告和注意事项(5.1)和药物相互作用(7.1)].
●阿片类药物的同时使用(如,哌替啶及其衍生物,美沙酮[methadone],丙氧芬[propoxyphene],或曲马多);5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRIs)三环,四环,或三唑吡啶抗抑郁药;环苯扎林;苯哌啶醋酸甲酯,安非他明,和它们的衍生物;或圣约翰草[St John’s wort]。同时使用可能导致危及生命5-羟色胺综合证[见警告和注意事项(5.2)和药物相互作用(7.2,7.3,7.5)]。
●右美沙芬的同时使用。曽报道MAO抑制剂和右美沙芬的联用致精神病或异常行为发作[见药物相互作用(7.4)]。
● 一个对safinamide超敏性史。反应曽包括舌和口粘膜肿胀,和呼吸困难。
● 严重的肝受损(Child-Pugh C:10-15)[见在特殊人群中使用(8.6)]。
5 警告和注意事项
5.1 高血压
XADAGO可能致高血压或加重存在高血压。在临床试验中,对XADAGO 50 mg高血压的发生率为7%,对XADAGO 100 mg为5%,和对安慰剂4%。监视患者XADAGO开始后不能适当控制对高血压或高血压的新发作。如血压升高持续可能需要调整药物。
监视对高血压如XADAGO被与交感神经药物同时地处方,包括处方或非处方鼻,口,和眼抗充血剂[decongestants]和感冒药[见药物相互作用(7.5)].
XADAGO在推荐剂量50 mg或100 mg每天是一个MAO-B选择性抑制剂。对抑制性MAO-B选择性减低上述推荐每天剂量[见临床药理学(12.2)]。所以,XADAGO不应在每天剂量超过那些推荐的因为高血压的风险,存在的高血压的加重,或高血压危象。
用推荐剂量XADAGO期间,不需要食谱酪胺限制。但是,与含非常高量某些食物使用(即,多于150 mg)的酪胺可能致严重的高血压,结果来自用推荐剂量XADAGO患者增加对酪胺敏感性,和建议患者应避免这类食物。
异烟肼[Isoniazid]有某些单胺氧化酶抑制活性。在同时地用异烟肼和XADAGO治疗患者监视对高血压和对食谱酪胺反应[见药物相互作用(7.1,7.6)]。
5.2 5-羟色胺综合证
在用MAO抑制剂用同时治疗患者 (包括选择性MAO-B抑制剂)5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRIs),三环抗抑郁药,四环抗抑郁药,三唑吡啶抗抑郁药,环苯扎林,阿片类药物(如,哌替啶和哌替啶衍生物,丙氧芬,曲马多),和苯哌啶醋酸甲酯,安非他明,和它们的衍生物曽报道一个潜在地危及生命5-羟色胺综合证的发展。XADAGO与这些药物的同时使用被禁忌。
在临床试验中,在用XADAGO治疗患者报道5-羟色胺综合证和一个SSRI。在有治疗同时XADAGO患者中使用SSRIs的最低有效剂量。5-羟色胺综合证症状可能包括精神状态变化(如,激动,幻觉,谵妄,和昏迷),自主性不稳定性(如,心动过速,易变血压,眩晕,出汗,脸红,体温过高),神经肌肉症状(如,震颤,强直,肌阵挛,反射亢进,共济失调),癫痫,和/或胃肠道症状(如,恶心,呕吐,腹泻)。
5.3 白天生活的活动期间入睡
用多巴胺能药物治疗患者曽报道当从事日常生活活动时入睡,包括操作汽车,它优势导致意外事故。患者 不会察觉到警示标志,例如过度嗜睡,或在事件之前立即他们可能会报告警告的感觉。
在临床研究中,用XADAGO 100 mg/day治疗患者中报道睡眠发作/睡眠突然发作。
如一例患者发生白天时睡眠或需要完全警觉活动期间入睡发作(如,驾驶汽车,会谈,进食),XADAGO通常地应被终止/如做出决定这些患者继续用XADAGO,建议他们避免驾驶和其他潜在危险活动。
5.4 运动功能障碍[Dyskinesia]
XADAGO可能致运动功能障碍或加重事先-存在的运动功能障碍。
在临床试验中,对XADAGO 50 mg运动功能障碍的发生率为21%,对XADAGO 100 mg为18%,和对安慰剂为9%。在用XADAGO 50 mg或100 mg治疗帕金森病患者(1%)与安慰剂(0%)比较,有更大运动功能障碍较大的发生率致研究终止[见不良反应(6.1)]. 。
减低患者的每天左旋多巴剂量或另一种多巴胺能药物的剂量可能减轻运动功能障碍。
5.5 幻觉/精神病行为
有一个主要的精神病障碍患者通常不应用XADAGO治疗因为加重精神病有中枢多巴胺能tone增加的风险。此外,对精神病拮抗多巴胺能药物治疗可能帕金森病的症状加重[见药物相互作用(7.8)]。
如患者用XADAGO时发生幻觉或精神病样行为,考虑剂量减低或停止药物。
5.6 控制冲动/强迫性行为
患者可能经受强烈冲动赌博[to gambe],增加性欲,强烈冲动化钱,暴食,和/或其他强烈冲动,和不能控制这些冲动当用一次或更多药物,包括XADAGO,增加中枢多巴胺能tone。在有些情况,这些冲动被报告有停止当剂量减低或药物被终止。因为患者可能不认识到这些行为为异常,重要的是对处方者特别地询问患者或他们的护理人员关于新或增加的赌博冲动,性冲动,不能控制的花钱或正在用XADAGO的其他冲动。如果一例当服用XADAGO时患者发生这类冲动考虑剂量减低或停止药物。
5.7 戒断出现高热症和混乱
一个症状复合类似于抗精神病药的恶性综合症综合证(特征为体温升高肌肉强直,改变意识,和自主性不稳定性),与无其他明显病因,在伴随迅速剂量减低,撤药(戒断),或增加中枢多巴胺能药物中变化曽被报道。.
5.8 视网膜病理学
在白和色素大鼠中口服毒性研究直至6个月时间,给予safinamide观察到视网膜退行性变性和光受体细胞缺失。在大白鼠给予口服safinamide共两年,在所有测试剂量视网膜瘢痕和白内障[见非临床毒理学(13.2)]。
定期地监视患者有视网膜/黄斑退行性变性,葡萄膜炎,遗传性视网膜条件,遗传性视网膜病的家族史,白化症,视网膜色素变性,或任何活动性视网膜病变的病史患者的视力变化(如,糖尿病视网膜病变).
6 不良反应
说明书的其他节更详细讨论以下严重的不良反应:
● 高血压[见警告和注意事项(5.1 )]
● 5-羟色胺综合证[见警告和注意事项(5.2)]
●入睡白天生活的活动期间[见警告和注意事项(5.3)]
● 运动功能障碍[见警告和注意事项(5.4)]
● 幻觉/精神病行为[见警告和注意事项(5.5)]
● 控制冲动/强迫性行为[见警告和注意事项(5.6)]
● 戒断出现高热症和混乱[见警告和注意事项(5.7)]
● 视网膜病理学[见警告和注意事项(5.8)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在安慰剂-对照帕金森病研究常见不良反应
表1显示在帕金森病对照研究(研究1和研究2)不良反应的发生率有一个发生率至少2%用XADAGO 100 mg/day和大于安慰剂。伴随XADAGO治疗最常见不良反应其中对XADAGO 100 mg/day发生率为至少2%大于安慰剂发生率为运动功能障碍,跌倒,恶心,和失眠。
不良反应作为对从研究终止理由
在合并安慰剂-对照研究(研究1和研究2)在有帕金森病患者服用稳定剂量的卡比多巴/左旋多巴有或无其他帕金森病(PD)药物,在XADAGO-治疗患者因为不良反应从研究终止的发生率有增加。对XADAGO 50 mg/day对任何不良反应从研究1和研究2终止患者的发生率为5%, 对XADAGO 100 mg/day为6%,和对安慰剂4%。致研究终止最频报道的不良反应为运动功能障碍(用XADAGO 50 mg/day或XADAGO 100 mg/day治疗患者为1%相比对安慰剂0%)。
在研究1和研究2中,对XADAGO 50 mg经受对血清丙氨酸氨基转移酶(ALT)从正常转变至正常上限以上患者的比例为5%,对XADAGO 100 mg组为7%,和对安慰剂为3%。No treated 用XADAGO治疗患者没有患者经受ALT一个增加是正常上限的3倍或更高。
对XADAGO 50 mg组血清天门冬氨酸氨基转移酶(AST)有一个转变从正常至高于正常上限患者的比例为7%,对XADAGO 100 mg组为6%,和对安慰剂为3%。对XADAGO和安慰剂在AST中有一个增加至至少3倍正常上限患者的发生率是相似。
6.2 上市后经验
在safinamide在美国以外批准后使用期间曽鉴定以下不良反应。因为这些反应是从一个大小不确定志愿报告的往往不可能可靠地估算它们的频数或确定与药物暴露的因果相互关系。
一个上市后报告描述了一名患者发生一个超敏性反应由舌和齿龈肿胀,呼吸困难和皮疹组成。XADAGO被终止后短期间症状解决终止,但1各月再挑战后再现。
7 药物相互作用
7.1 MAO抑制剂
XADAGO是禁忌与在MAO抑制剂类其他药物使用或其他药物是单胺氧化酶的强效抑制剂(如,利奈唑胺,一个症状短地后被解决,它也有可逆性非选择性MAO抑制活性)。共同给药增加非选择性MAO抑制作用风险,它可能导致高血压危象[见禁忌证(4)和警告和注意事项(5.1)]。XADAGO终止和用其他MAOIs开始治疗间应至少14天。异烟肼有某些单胺氧化酶抑制活性。用异烟肼和XADAGO同时治疗患者中监视对高血压和对食谱酪胺反应。
7.2 阿片类药物
因为XADAGO与阿片类药物的同时使用曽促进严重的,有时致命反应(如,哌替啶及其衍生物,美沙酮,丙氧芬,或曲马多)和禁忌MAO抑制剂s,包括选择性MAO-B抑制剂,这些药物的同时使用被禁忌[见警告和注意事项(5.2)]。XADAGO的终止和用这些药物开始治疗间至少过去14天。.
7.3 5羟色胺能药物
XADAGO与SNRIs的同时使用;三唑吡啶,三环或四环抗抑郁药;环苯扎林(一种骨骼肌松弛药是一种三环抗抑郁衍生物);或圣约翰草被禁忌[见警告和注意事项(5.2)]。XADAGO的终止和用这些药物开始治疗间应至少经过14天。
如选择性5-羟色胺再摄取抑制剂是被用XADAGO治疗患者使用监视患者5-羟色胺综合证5-羟色胺综合证的症状[见警告和注意事项(5.2)]。
MAO抑制剂和右美沙芬的联用曽被报道致精神病的发作或怪异行为[bizarre behavior]。所以,鉴于在XADAGO的MAO抑制剂活性,右美沙芬被禁忌与XADAGO使用。
7.5 交感神经药物
拟交感神经药和非选择性MAO抑制剂的给药后曽接着高血压反应。服用推荐剂量选择性MAO-B抑制剂和交感神经药物患者曽被报道高血压危象。 XADAGO与苯哌啶醋酸甲酯,安非他明,和它们的衍生物的同时使用 被禁忌[见警告和注意事项(5.1,5.2)]。
如XADAGO被处方同时地与被处方与处方或非处方交感神经药物,包括鼻,经口,或眼科抗充血剂[decongestants]和感冒药监视患者对高血压[见警告和注意事项(5.1)].
7.6 酪胺
MAO在胃肠道和肝脏中(主要地型)提供来自外源性胺类保护(如,酪胺)。如酪胺被完整吸收,它可能导致严重的高血压,包括高血压危象。过期,发酵,腌制,熏制和腌制食品含大量外源性l类l如,过期的奶酪,腌鲱鱼) 可能致血压升高(酪胺反应)。当服用推荐剂量的XADAGO患者应被忠告避免食物含一个大量的酪胺[见警告和注意事项(5.1)]。
在高于最高推荐每天剂量一个剂量-相关方式对抑制MAO-B减低的选择性,它可能对高血压增加风险[见临床药理学(12.2)]。此外,异烟肼有某些单胺氧化酶抑制性活性。用异烟肼和XADAGO治疗患者中监视对高血压和对食谱酪胺反应[见警告和注意事项(5.1)]。
7.7 乳癌耐药蛋白的底物(BCRP)
Safinamide及其主要代谢物可能抑制肠道乳腺癌耐药蛋白(BCRP)[见临床药理学(12.3)]。BCRP的抑制作用可能增加BCRP底物的血浆浓度。BCRP底物的实例包括氨甲喋呤[methotrexate],米托蒽醌[mitoxantrone],伊马替尼[imatinib],伊立替康[irinotecan],拉帕替尼[lapatinib],罗苏伐他汀[rosuvastatin],柳氮磺吡啶[sulfasalazine],和拓扑替康[topotecan]。 如XADAGO被同时地使用监视患者对BCRP底物药理学或不良效应的增加。
7.8 多巴胺能拮抗剂
多巴胺拮抗剂,例如抗精神病药或甲氧氯普胺[metoclopramide],可能减低XADAGO有效性和加重帕金森病的症状。
8 在特殊人群中使用
8.1 妊娠
妊娠类别C
在妊娠妇女中没有XADAGO的适当和对照良好研究。在动物中,当妊娠期间safinamide被给予在临床上相关剂量观察到发育毒性,包括致畸胎效应。当妊娠期间safinamide与左旋多巴/卡比多巴联用,在safinamide剂量低于临床上使用时观察到发育毒性。妊娠期间仅如潜在获益公正地胜过对胎儿潜在风险时才应使用。
在大鼠中一项胚胎胎儿发育研究,器官形成期自始自终口服给予safinamide(0,50,100,或150 mg/kg/day)导致在所有剂量中,剂量-相关的胎儿异常(主要地泌尿生殖畸形)。最低测试剂量是约5倍的最大推荐人剂量(MRHD)100 mg在一个体表面积(mg/m2)基础上。在大鼠中一项safinamide和左旋多巴(LD)/卡比多巴(CD)联合胚胎胎儿发育研究(80/20 mg/kg/day LD/CD与0,25,50,或100 mg/kg/day safinamide组合或单独100 mg/kg/day safinamide)在所有剂量safinamide与CD/LD组合和单独用safinamide都观察到胎儿内脏和骨骼畸形和变异的发生率增加。最低safinamide被测试剂量(25 mg/kg/day)是大约2倍的MRHD在一个mg/m2基础上。
在兔中胚胎胎儿发育研究,未观察到发育毒性直至最高口服被测试的safinamide剂量(100 mg/kg/day)。但是,当safinamide(4,12,或40 mg/kg/day)在器官形成期自始至终被给予在一个safinamide与LD/CD(80/20 mg/kg/day LD/CD组合研究中)与单独LD/CD比较胚胎胎儿死亡和心脏和骨骼畸形的发生率增加。对safinamide没有确定一个无效应剂量;被测试safinamide的最低有效剂量(4 mg/kg/day)是低于MRHD在一个mg/m2基础上。
在一项大鼠围产期[pre-and postnatal]发育研究,口服给予safinamide(0,4,12.5,或37.5 mg/kg/day)妊娠和哺乳自始至终导致子代皮肤变色,被假定是由于肝胆毒性引起的,在中间和高剂量和减低体重和增加产后死亡率在子代在最高测试剂量。无效应剂量(4 mg/kg/day)是低于MRHD在一个mg/m2 基础上。
8.3 哺乳母亲
在大鼠幼畜中观察到皮肤变色,被假定是被高胆红素血症来自肝胆毒性所致,在哺乳阶段经过乳汁间接地暴露于safinamide。不知道在人乳汁中是否存在这个药物。因为许多药物被排泄在人乳汁中和因为在哺乳婴儿来自safinamide对严重的不良反应潜能,应做出一个决定是否继续哺乳或终止药物,考虑药物对母亲的重要性。
8.4 儿童使用
尚未确定在儿童患者中XADAGO的安全性和有效性。在动物中尚未进行幼兽毒性研究。
8.5 老年人使用
在临床研究中1516例受试者暴露于XADAGO中,38%为65岁和以上,而4%为75和以上。这些患者和较年轻患者间未观察到在安全性或有效性总体差别,和其他被报道的临床经验未曽鉴定老年人和较年轻患者间反应中差别,但不能除外有些老年个体更大敏感性。
8.6 肝受损
在有肝受损患者中XADAGO血浆浓度增加[见临床药理学(12.3)]。
在有中度肝受损患者(Child-Pugh B:7-9),XADAGO的最大推荐剂量为50 mg每天1次[见剂量和给药方法(2.2)]。在有严重的肝受损患者中未曽研究XADAGO (Child-Pugh C:10-15),和在这些患者中是禁忌。如患者从中度进展至严重的肝受损,用XADAGO治疗应被停止。
10 药物过量
没有用XADAGO过量人经验。
对XADAGO没有已知的抗毒药也没有对XADAGO过量任何特异性治疗。如发生一个重要过量,XADAGO治疗应被终止和临床上有适应证时应被给予支持治疗。在用XADAGO过量情况中,食谱酪胺限制应被观察共几周。
对最当前治疗指导应电话美国毒物控制中心电话1-800-222-1222。
11 一般描述
XADAGO片含safinamide,它是一种MAO-B 抑制剂,为甲磺酸盐。Safinamide甲磺酸盐是(S)-2-[[4-[(3-fluorophenyl) methoxy]phenyl]methyl]aminopropanamide methanesulfonate(1:1)和其结构式如下:
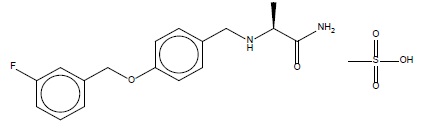
Safinamide的甲磺酸盐的分子式是C17H19FN2O2•CH4O3S和其分子量为398.45。
Safinamide甲磺酸盐是一种白色至米白色结晶粉。Safinamide甲磺酸盐是易溶于水,甲醇和二甲亚碸。Safinamide甲磺酸盐微溶于乙醇和是实际上不溶于乙醚。在水性缓冲液跨越pH范围1.2至7.5,safinamide甲磺酸盐是高度溶于1.2和4.5,但是显示低溶解度(<0.4 mg/mL)在pH 6.8和7.5。
XADAGO是可得到为50 mg和100 mg膜包衣片为口服。每个XADAGO片含65.88 mg或131.76 mg的safinamide甲磺酸盐,分别于50 mg或100 mg的safinamide游离碱。片还含以下无活性成分:胶体二氧化硅,交联聚维酮,羟丙甲纤维素,氧化铁(红),硬脂酸镁,微晶纤维素,聚乙二醇6000,矽酸钾铝,和二氧化钛。
12 临床药理学
12.1 作用机制
不知道在金森病中XADAGO发挥其作用的精确机制。XADAGO是单胺氧化酶B(MAO-B)的一个抑制剂。MAO-B活性的抑制作用,通过阻断多巴胺降解代谢,被认为倒是说说多巴胺水平增加和在脑中随后多巴胺能活性增加。
12.2 药效动力学
XADAGO抑制单胺氧化酶B(MAO-B),选择性超过MAO-A高于1000-倍。在临床研究中,在剂量> 20 mg MAO-B测量到完全抑制作用(>90%)。
酪胺挑战测试
在一项口服酪胺挑战研究中,XADAGO产生一个明显相对小对酪胺血压敏感性增加。这个结果提示XADAGO在一个剂量50 mg或100 mg是相对地选择性对抑制MAO-B和可被使用无食谱酪胺限制。高于最高推荐每天剂量(100 mg),XADAGO对抑制MAO-B的相对选择性减低 [见警告和注意事项(5.1)和药物相互作用(7.6)]。
心脏电生理学
在一项随机化安慰剂和阳性对照双盲,多-剂量平行彻底QTc研究在240健康受试者评价XADAGO对QTc间期的影响。在一个剂量350 mg(最大推荐剂量的3.5倍),XADAGO不延长QTc间期。.
12.3 药代动力学
Safinamide的药代动力学跨越50 mg至300 mg范围是线性(3倍最大推荐每天剂量)。在5至6天内达到稳态。
吸收
在空腹条件下单次和多次口服给药,safinamide的Tmax范围范围从2至3小时。口服给药后safinamide的绝对生物利用度为95%。首过效应是可忽略不计。在进食状态与空腹条件比较,观察到Tmax中略微延迟,但对safinamide的AUC0−∞和Cmax没有影响[见剂量和给药方法(2.1)]。
分布
分布容积(Vss)是约165 L,表明广泛血管外分布。Safinamide不是高度地蛋白结合(非结合分量为11至12%)。
代谢和排泄
在人中,safinamide是几乎广泛地通过代谢被消除(~5%的药物是未变化的消除,主要地在尿中),通过三个主要代谢途径。一个途径涉及酰胺部分水解氧化作用导致主要的代谢物‘safinamide酸’(NW-1153)。另一个途径是醚键的氧化裂解形成‘Odebenzylated safinamide’(NW-1199)。最后,通过或safinamide或主要的safinamide酸代谢物(NW-1153)酰胺键的氧化裂解形成‘N-脱烷基酸’(NW-1689)。‘N-脱烷基酸’(NW-1689)与葡萄糖醛酸进行进一步结合产生它的酰基葡萄糖醛酸苷。在人血浆中NW-1689是主要循环的代谢物,超过母药的暴露(母药的161%)。NW-1689 AG和NW-1153分别占母药暴露的约18%和11%。没有代谢物有药理学活性。
Safinamide 是主要地通过非微粒体酶被代谢(胞液细胞液酰胺酶/MAOA);在它的总体生物转化中CYP3A4和其他CYP同工酶仅起次要作用。
Safinamide的总清除率被测定是4.6 L/h。末端半衰期为20-26 h。排泄的主要途径是肾(在尿中回收76%的safinamide剂量,主要在无活性代谢物形式)。
特殊人群
年龄:老年人群:在老年人中对XADAGO的使用是有限的临床数据(>75 years)。这些数据提示safinamide的药代动力学不受年龄影响[见在特殊人群中使用(8.5)]。
种族:safinamide的药代动力学不受种族影响。.
性别:safinamide药代动力学不受性别影响。.
肝受损:在受试者有轻度和中度肝受损和有正常肝功能受试者比较评估XADAGO的处置。在有轻度肝受损受试者(Child-Pugh A)中观察到Safinamide的暴露中有边界增加(AUC增加约30%)。在有中度肝受损(Child-Pugh B)受试者,对safinamide暴露是增加约80%(CI:154-215%)[见剂量和给药方法(2.2)和在特殊人群中使用(8.6)].。尚未在有严重的肝受损患者(Child-Pugh C)研究XADAGO[见禁忌证(4)]。
肾受损:
在有中度肾受损,严重的肾受损,或正常肾功能受试者的一项开放,平行组,单次口服剂量研究肾受损对safinamide 药代动力学的影响,safinamide药代动力学不受受损的肾功能影响。
药物相互作用研究
体外研究:
体外代谢研究表明被safinamide及其主要代谢物在对给药相关浓度,表明无基于细胞色素P450(CYP)酶有意义抑制作用或诱导作用。Safinamide或其主要代谢物在临床上相关浓度是不是MAO-A,左旋多巴脱羧酶或醛脱氢酶的抑制剂。
Safinamide不是P-gp底物。Safinamide及其代谢物不抑制P-gp或其他转运蛋白OCT2,OATP1B1,OATP1B3,BSEP,OAT1/3/4。在100 mg 剂量Safinamide和NW-1689可能抑制BCRP。
体外研究:
用酮康唑[ketoconazole],左旋多巴(LD)和CYP1A2和CYP3A4底物(分别咖啡因[caffeine]和米达唑仑[midazolam])进行专门药物-药物相互作用研究,对XADAGO的药代动力学图形,或对共同给药左旋多巴或CYP1A2和CYP3A4底物的药代动力学图形没有显示任何临床上意义影响。.
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
癌发生
在小鼠和大鼠中致癌性研究,safinamide被给药分别在口服剂量0,50,2 100和200 mg/kg/day,和0,25,50和100 mg/kg/day,共2年。在两种动物种属中最高测试剂量为约10倍的最大推荐人剂量(MRHD)的100 mg/day在体表面积(mg/m2)基础上。在任一动物种属未观察到肿瘤生成潜能的证据。.
突变发生
Safinamide在体外(Ames,小鼠淋巴瘤)和体内(小鼠微核)试验对遗传毒性是阴性。
生育力受损
在一项大鼠生育力研究其中雄性和雌性被口服给予safinamide(0,50,100,150 mg/kg/day)交配前和期间和在雌性继续至早期妊娠,观察到在两种雄性对生殖功能不良效应(精子异常)和雌性(减少黄体,增加植入前丢失)。对生殖毒性的无效应剂量(50 mg/kg/day)约是5倍的MRHD在一个mg/m2基础上。
13.2 动物毒理学和/或药理学
视网膜病理学
在大鼠中
在血浆暴露低于在人中在最大推荐的人剂量100 mg/kg/day,在白大鼠和色素大鼠两者的视网膜都观察到光受体细胞的退行性变性的丢失。这个发现为剂量-和时间-依赖性和从最小丢失进展至严重的外层核细胞层丢失,在口服给予safinamide一年后。在一项两年研究中,在所有口服测试剂量(0,25,50,和100 mg/kg/day)都见到总视网膜萎缩和瘢痕形成和晶体混浊(白内障)。
在一项大鼠研究中大鼠口服给予单独safinamide或与普拉克索[pramipexole]联用,普拉克索,在一个剂量(25 mg/kg/day)不引起视网膜变化,色素的和白大鼠两者单独safinamide(50 mg/kg/day)加重视所致的网膜病理学。
研究性研究不能确定视网膜毒性潜在的机制;不知道与人相关性。
14 临床研究
14.1在有帕金森病患者经受没有时间用一个稳定剂量的左旋多巴辅助治疗.
两项双盲,安慰剂-对照,多-国家,24-周研究(研究1和研究2)被进行在PD患者经受“没有用[OFF]”用卡比多巴/左旋多巴治疗期间的时间和其他PD药物,如,多巴胺激动剂,儿茶酚[catechol]-O-甲基转移酶(COMT)抑制剂,抗胆碱能药,和/或金刚烷胺[amantadine]。在两项研究中,有效性的主要测量是从基线变化在总每天“用药[ON]”时间无令人麻烦的运动功能障碍(即,”用药ON”时间无运动功能障碍加”用药ON”时间与非-令人麻烦的运动功能障碍),根据被患者完成的18-小时 日记计划时间表访问的每个前共至少3天。次要终点包括日记期[diary period]时和在统一的帕金森病计分量表(UPDRS)部分III(运动检查)中“没有用”时间的减低。.
在研究1中,患者(n=645)被随机化等同地至用XADAGO 50 mg/day (n=217患者),XADAGO 100 mg/day(n=216患者),或安慰剂(n=212患者)治疗,和有至少一次基线后”用药ON”时间的评估。
用稳定剂量的其他类别的PD药物患者的百分率,除了左旋多巴/脱羧酶抑制剂,为:多巴胺激动剂(61%),COMT抑制剂(24%),抗胆碱能药(37%),和金刚烷胺(14%)。禁止使用MAO抑制剂。左旋多巴的均数每天剂量为630 mg。帕金森病的均数时间为约8年。”用药ON”时间期间评估的在统一的帕金森病计分量表部分III(UPDRS III)评分中一个减低(表3)。在“用时间”中发生的改善无一个令人麻烦的运动功能障碍中增加。
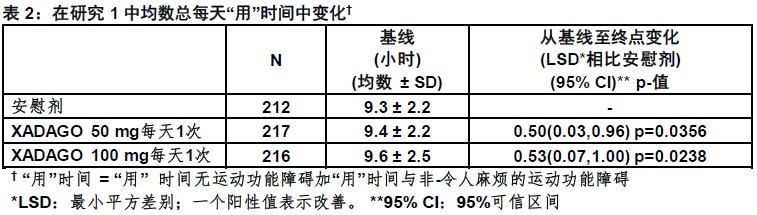
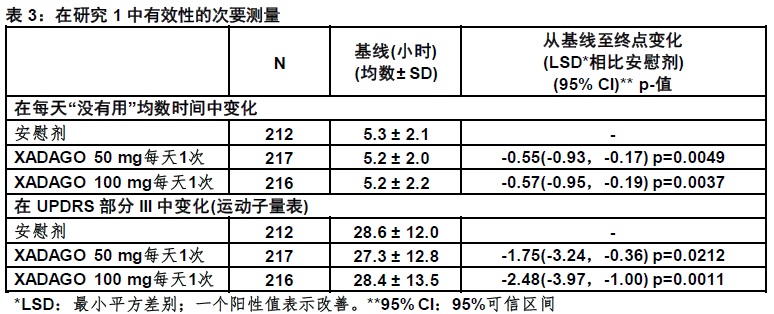
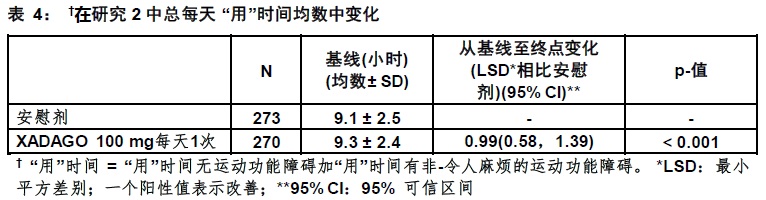
XADAGO 100 mg对”用”时间的影响在数字上仅略微大于XADAGO 50 mg的影响。此外,在总每天”用药ON”时间改善的时间过程在两个剂量间是相似(图1)。用XADAGO 50mg和100 mg两个剂量组与安慰剂比较,在所有基线后时间点显示在总每天”用药ON”时间中数字上较大改善(图1)。
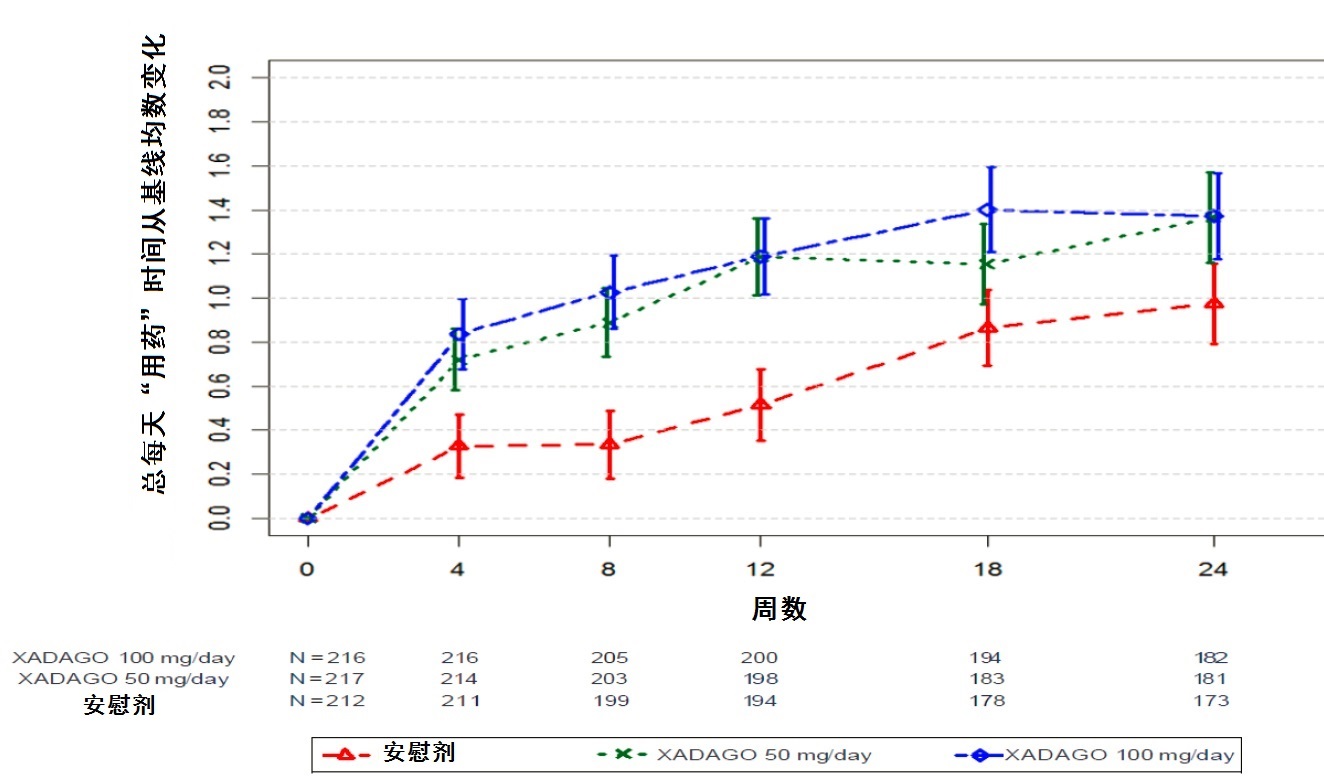
图2显示在研究1在总每天 “用药ON”时间对基线至24周变化经验累计分布函数(CDF)。对XADAGO 50 mg和100 mg组有一个变化在“用药ON”时间患者的累计百分率相似。对XADAGO 50 mg和100 mg治疗患者两者“用药ON”时间比对安慰剂患者增加较高的患者的累计百分率较高。
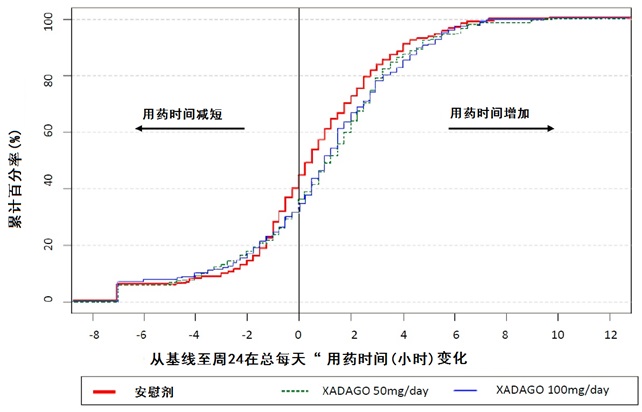
图2:研究1对在总每天 “用药ON” 时间基线至24周变化经函数验累计分布(CDF)。
因为一个不良反应,缺乏疗效,不顺从,或撤出知情同意退出研究被处理为治疗失败和其中所有患者假定从基线最小变化。对安慰剂组,XADAGO 50 mg/day组,和XADAGO 100 mg/day组失败率分别是6.1%,5.6%,和6.9%。
在研究2中,患者(n=549)被随机化至治疗用XADAGO100 mg每天服用稳定剂量的其他类别的帕金森病(PD)药物,除了左旋多巴/脱羧酶抑制剂,为多巴胺激动剂(74%),COMT抑制剂 (18%),抗胆碱能药(17%),和金刚烷胺(30%)。MAO抑制剂的使用被禁止。左旋多巴的平均每天剂量为777 mg。帕金森病的平均时间约9年。
在研究2中,XADAGO是显著地优于安慰剂对增加”用药ON”时间(表4)。观察的无令人麻烦的运动功能障碍”用药ON”时间增加是伴随一个相似幅度是的“没有”时间的减少和在UPDRS III评分中减少(“用药ON”时间期间评估)。效应的时间过程是相似于对研究1上面图所示。如同在研究1,在无令人麻烦的运动功能障碍中”用药ON”时间的增加伴随一个相似的在在“没有”时间显著减少和”用药ON” 时间评估的在统一的帕金森病计分量表部分III(UPDRS III)评分减低(表5)。
在总每天”用药ON”时间改善的时间过程显示在所有基线后时间点用XADAGO 100 mg数字上比用安慰剂更大改善(图3)。
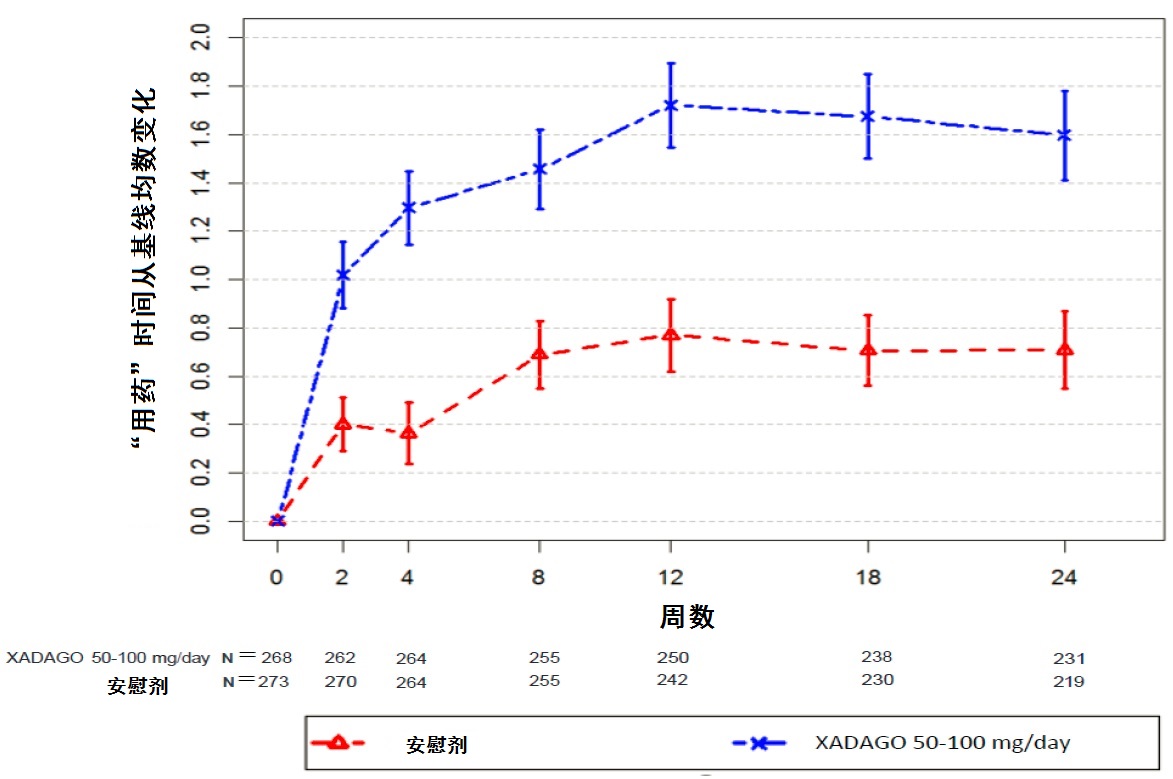
图3:在研究2中总每天 “用药ON”时间按周从基线变化均数。
图4显示在研究2总每天 “用药ON”时间对从基线至周24变化的经验累计分布函数(CDF)。用XADAGO 50 mg至100 mg治疗患者在“用药ON”时间增加是较高于安慰剂患者的累计百分率。
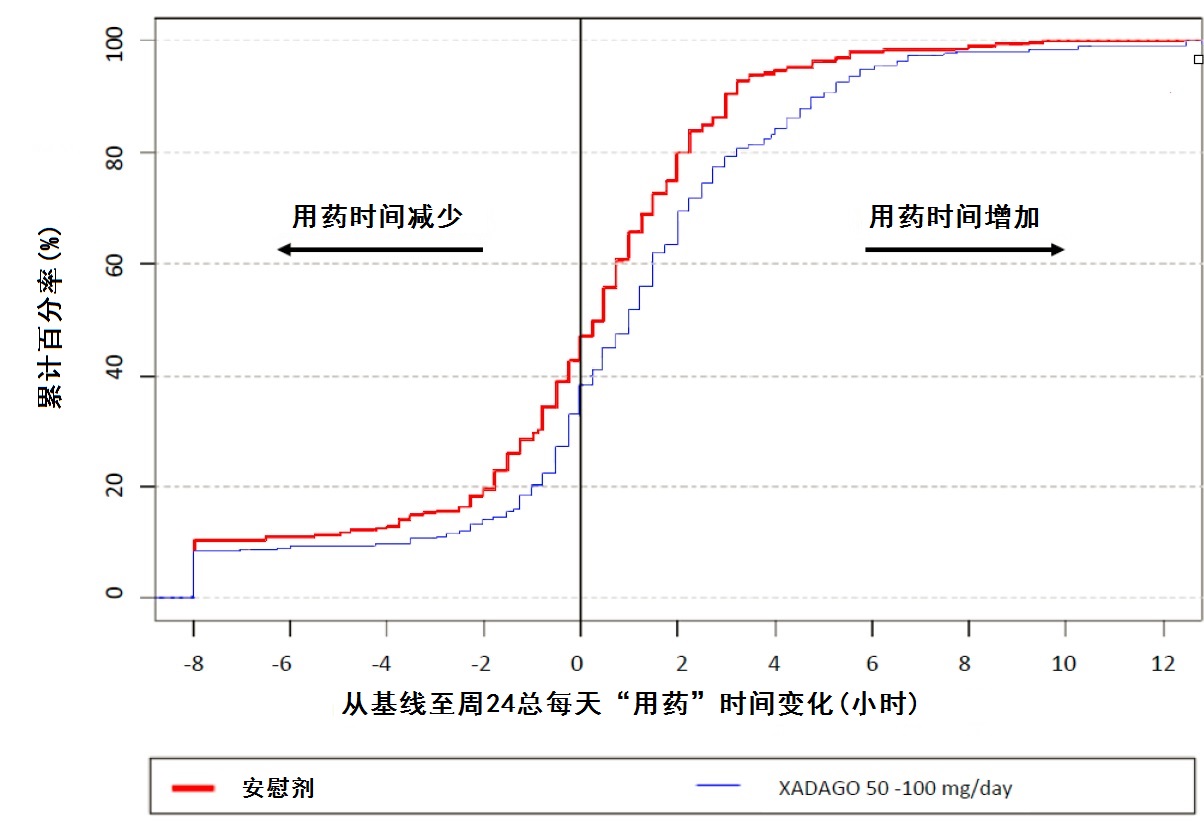
图4:研究2在总每天“用药ON”时间从基线至周24变化经函数验累计分布(CDF)。
16 如何供应/贮存和处置
16.1 如何供应
50 mg(橙色至铜色有金属光泽,圆形膜包衣,双凹形片一侧凹陷有“50”;约7 mm直径)
30片瓶………NDC 27505-110-30
90片瓶………NDC 27505-110-90
100 mg(橙色至铜色有金属光泽,圆形膜包衣,双凹形片,一侧凹陷有“100”;约9 mm直径). 30片瓶………NDC 27505-111-30
90片瓶………NDC 27505-111-90
16.2 贮存和处置
贮存在25°C(77°F);外出允许15°C至30°C(59°F至86°F)间[见USP控制室温]。
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(患者资料)。
高血压
忠告患者用XADAGO推荐剂量治疗可能被伴随有血压升高或高血压发作。告诉当服用XADAGO经受血压升高患者联系他们的卫生保健提供者。
解释使用较高于推荐每天XADAGO剂量,和提供酪胺伴随高血压反应的简要描述。
建议患者避免某些食物(如,过期的奶酪) 含一个非常大量的酪胺当赋予推荐剂量的XADAGO因为血压巨大增加的潜能。如患者吃富有酪胺后马上感觉不好,他们应联系他们的卫生保健提供者[见警告和注意事项(5.1)]。
5-羟色胺综合证
告诉患者如他们正在服用,或计划服用,任何处方或非处方药物告知他们的医生,尤其是抗抑郁药和非处方感冒药物,因为与XADAGO相互作用的潜能。因为患者不应与XADAGO使用哌替啶或某些其他镇痛药,在服用新药包括抗抑郁药,镇痛药,和处方药或非处方抗充血剂前他们应联系他们的卫生保健提供者[见禁忌证(4)和警告和注意事项(5.2)]。
在日常生活和嗜睡活动中睡着了
告知患者伴随XADAGO和其他多巴胺能药物关于对镇静效应潜能,包括嗜睡和特别是当从事日常生活活动时入睡的可能性。因为嗜睡可能是一种频繁不良反应有潜在严重后果,患者不应操作汽车或从事其他潜在地危险性活动直至他们已得到用XADAGO充分经验。
忠告患者如入睡白天生活的活动期间增加嗜睡或新发作(如,看电视,作为车中乘客,等等)治疗期间任何时间被经受,治疗期间他们不应驾驶或参与潜在危险性活动直至他们已联系他们的医生。患者不应驾驶,操作机械,或在高处工作如XADAGO的使用前他们以前已经历嗜睡和/或无警告入睡。
因为相加作用的可能性,忠告患者当正在服用其他镇静药物,酒精,或其他中枢神经系统镇静药(如,苯二氮卓类,抗精神病药,抗抑郁剂)与XADAGO联用关于增加嗜睡的潜能[见警告和注意事项(5.3)]。
运动功能障碍
建议患者用XADAGO作为对左旋多巴辅助有运动功能障碍或运动功能障碍增加的可能性[见警告和注意事项(5.4)]。
幻觉/精神病行为
告知患者当用XADAGO时可能发生幻觉或精神病行为的其他表现。建议患者如他们有一个主要的精神病障碍, XADAGO通常不应使用因为加重精神病的风险。患者有一个主要的精神病障碍也应认识到对精神病许多治疗可能减低XADAGO的有效性[见警告和注意事项(5.5)和药物相互作用(7.8)]。
控制冲动/强迫性行为
忠告患者他们可能经受强烈冲动想赌博,增加性欲,其他强冲动,和当服用XADAGO时不能控制这些冲动没有证明药物致这些事件,报道当剂量减低或停止药物时,在有些病例中这些冲动停止。处方者应询问患者当正在被用XADAGO治疗有关新或增加赌博冲动,性冲动,或其他冲动的发生发展。患者应告知他们的医生如他们服用XADAGO经受这些冲动[见警告和注意事项5.6]。
戒断出现高热症和混乱
告诉患者联系他们的卫生保健提供者如他们想终止XADAGO和寻求指导对滴定调整XADAGO替代突然地终止XADAGO[见警告和注意事项(5.7)]。
缺失剂量
指导患者按处方用XADAGO。如缺失一剂,指导患者在通常在下一天的通常时间服用下一剂量。
同时药物
建议患者告知他们的医生如他们正在服用,或计划服用,任何处方或非处方药物因为对相互作用的一个潜能[见禁忌证(4),和药物相互作用(7.3,7.4,和7.5)]。

