批准日期: 2017年3月28日;公司:Genentech,Inc.
第一个药物被批准为原发性进展型多发性硬化[Primary Progressive MS]
这是第一个被FDA为PPMS批准的药物。FDA的药品评价和研究中心的神经学产品部主任Billy Dunn,M.D.说:“多发性硬化对人的生命可能有深刻影响,” “这个治疗不仅为有复发MS患者提供另一种治疗选择,而且首次为那些有原发性进展型多发性硬化患者提供另一种治疗选择。” 突破性治疗指定,快速通道指定,和优先审评。
http://www.gene.com/
处方资料重点
这些重点不包括安全和有效使用OCREVUS需所有资料。请参阅OCREVUS完整处方资料。
OCREVUSTM(ocrelizumab)注射液,为静脉使用
美国初次批准:2017
适应证和用途
OCREVUS是一个指向CD20细胞溶解抗体适用为有复发或原发进展性型的多发性硬化症患者的治疗(1)。
剂量和给药方法
● 首次剂量前要求乙型肝炎病毒筛选。(2.1)
● 每次输注前用甲泼尼龙[methylprednisolone](或一种等同的皮质激素)和一种抗组织胺(如,苯海拉明[diphenhydramine])预先给药.(2.2)
● 通过静脉输注给予OCREVUS
o 开始剂量:300 mg静脉输注,接着两周以后给予第二次300 mg静脉输注(2.3)
o 随后剂量:600 mg静脉输注每6个月(2.3)
● 给药前必须稀释(2.3,2.6)
● 期间密切地监视患者和输注后共至少一小时.(2.3,2.5)
剂型和规格
● 注射液:300 mg/10 mL(30 mg/mL)在一个单次-剂量小瓶.(3)
禁忌证
● 活动性乙型肝炎病毒感染(4)
● 对OCREVUS危及生命输注反应史(4)
警告和注意事项
● 输注反应:对输注反应处理建议依赖于反应的类型和严重程度。永久地终止OCREVUS如发生一种威胁生命或禁用输液反应。(2.3,5.1)
● 感染:在有一个活动感染患者延迟OCREVUS给药直至感染被解决。用OCREVUS治疗期间和终止后建议不用活减低或活疫苗疫苗接种,直至B-细胞充分供应(5.2)
● 恶性病:用OCREVUS可能存在恶性病的风险增加,包括乳癌。(5.3)
不良反应
最常见不良反应为:
● RMS(发生率 ≥10%和> REBIF):上呼吸道感染和输注反应(6.1)
● PPMS(发生率 ≥10%和> 安慰剂):上呼吸道感染,输注反应,皮肤感染,和下呼吸道感染(6.1)
报告怀疑不良反应,联系Genentech电话1-888-835-2555或FDA at 1-800-FDA-1088或www.fda.gov/medwatch。
在特殊人群中使用
● 妊娠:根据动物数据,可能致胎儿危害。(8.1)
完整处方资料
1 适应证和用途
OCREVUS是适用为有复发或原发进展性型的多发性硬化症成年患者的治疗。
2 剂量和给药方法
2.1 OCREVUS的首次剂量前评估
乙型肝炎病毒筛选
OCREVUS开始前,进行乙型肝炎病毒(HBV)筛选。对HBsAg和抗-HBV测试阳性结果确证的有活动性HBV患者OCREVUS被禁忌。对表面抗原[HBsAg]阴性的患者和对HB核心抗体[HBcAb+]阳性或是 HBV[HBsAg+]的携带者,治疗开始前和期间咨询肝病专家[见警告和注意事项(5.2)]。
疫苗接种
治疗期间和终止后直至 B-细胞充分供应因为建议不用活-减毒或活疫苗疫苗接种, OCREVUS开始前至少6周按照免疫准则给予所有需要的免疫接种[见警告和注意事项(5.2)和临床药理学(12.2)]。
2.2 每次输注前制备
感染评估
OCREVUS的每次输注前,确定是否有一个活动性感染。在活动性感染的情况中,延迟 OCREVUS的输注直至感染解决[见警告和注意事项(5.2)]。
预先给药的建议
用100 mg甲泼尼龙(或一种等同的皮质激素)预先给药。次OCREVUS输注前约30分钟静脉地给药减低输注反应频数和严重程度[见警告和注意事项(5.1)]。用一种抗组织胺(如,苯海拉明)每次OCREVUS输注前约30-60分钟预先给药进一步减低输注反应频数和严重程度。
可能考虑添加一种退热药(如,对乙酰氨基酚[acetaminophen])。
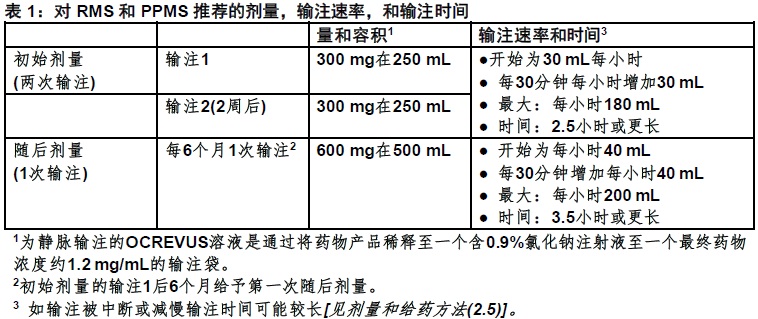
2.3 推荐的剂量和给药方法
在一位有经验卫生保健专业人员的严格监督下给予OCREVUS与取得适当的医学支持以处理严重的反应例如严重的输注反应。
● 初始剂量:300 mg静脉输注,接着两周以后给予第二次300 mg静脉输注。
● 随后剂量:每6个月单次600 mg静脉输注。
● 输注的完成后观察患者共至少一小时[见警告和注意事项(5.1)]。
2.4 延迟或缺失剂量
如缺失一次计划输注的OCREVUS,尽可能马上给予OCREVUS;不等待直至下一次时间表剂量。缺失剂量给药后重新设定给药时间表以给予下一次顺序6个月剂量。Doses of OCREVUS的剂量必须被至少5个月分开[见剂量和给药方法(2.3)]。
2.5 因为输注反应剂量修饰
对输注反应反应中剂量修饰依赖于严重程度。
危及生命输注反应
如存在一个威胁生命或禁用输液反应的征象立即地停止和永久地终止OCREVUS [见警告和注意事项(5.1)]。提供适当的支持治疗。
严重的输注反应
必要时,立即地中断输注和给予适当的支持治疗[见警告和注意事项(5.1)]。仅在所有症状已解决时重新开始输注。当重新开始时,在输注反应的发作时在输注速率一半开始[见剂量和给药方法(2.2)]。如该速率被耐受如表1内所述增加速率。。速率变化将增加输注总时间但总剂量不增加。
轻至中度输注反应
在输注反应发生时减低输注速率一半和维持减低速率共至少30分钟[见警告和注意事项(5.1)]。如该速率被耐受,按表1所述增加速率。这个速率变化将增加总时间而不是总剂量。
2.6 为输注稀释溶液的制备和贮存
制备
OCREVUS必须由一位卫生保健专业人员用无菌术制备。
给药前视力观察颗粒物质和变色。如溶液变色或如溶液含离散的外来颗粒物质不要使用。不要摇晃。.
抽吸意向剂量和进一步稀释至含0.9%氯化钠注射液输注袋,至最终药物浓度约1.2 mg/mL。
● 抽吸10 mL(300 mg)的OCREVUS和注入至250 mL。
● 抽吸20 mL(600 mg)的OCREVUS和注入至500 mL
不要使用其他稀释液稀释OCREVUS因为他们的使用尚未测试。产品不含防腐剂和仅被意向单次使用。
输注溶液的贮存
静脉输注的开始前,输注袋内容物应处于室温。
立即使用制备好的输注溶液。如不立即使用。在冰箱2°C–8°C(36°F–46°F)贮存至24小时和在室温25°C(77°F)至8小时,其中包括输注时间。静脉输注事件不能在相同天完成,遗弃保留溶液。
观察到OCREVUS和聚氯乙烯(PVC)或聚烯烃(PO)袋间和静脉(IV) 给药装置没有不兼容性。
给药方法
通过一个专用线用一个输注装置有一个0.2或0.22 micron在线滤器给予稀释输注溶液。.
3 剂型和规格
注射液:300 mg/10 mL(30 mg/mL)透明或略微地乳白色,和无色至浅褐色溶液在一个单次-剂量小瓶。.
4 禁忌证
在以下患者禁忌OCREVUS:
● 活动性HBV感染[见剂量和给药方法(2.6)和警告和注意事项(5.2)]
● 一个对OCREVUS危及生命输注反应史[见警告和注意事项(5.1)]
5 警告和注意事项
5.1 输注反应
OCREVUS可能致输注反应,它可能包括瘙痒,皮疹,荨麻疹,红斑,支气管痉挛,喉刺激,口咽炎,呼吸困难,咽或喉水肿,脸红,低血压,发热,疲乏,头痛,眩晕,恶心,和心动过速。在多发性硬化症(MS)临床试验,在OCREVUS-治疗患者中输注反应发生率[患者接受甲泼尼龙(或一种等同甾体)和可能其他预先药物以减低每次输注前输注反应风险]为34至40%,用首次输注有最高发生率。无致命性输注反应,但0.3%的OCREVUS-治疗MS患者经历输注反应是严重的,有些需要住院。
用OCREVUS治疗患者输注期间和输注后完成输注反应后观察共至少一小时。告知患者输注后至24小时可能发生输注反应。.
减低输注反应的风险和处置输注反应
给予预先给药(如,甲泼尼龙或一个等同皮质激素,和一个抗组织胺)以减低输注反应的频数和严重程度。可能还考虑添加一个退热药(如,对乙酰氨基酚)[见剂量和给药方法(2.3)]。
对输注反应处理建议依赖于反应的类型和严重程度[见剂量和给药方法(2.5)]。对危及生命输注反应,立即和永久地停止OCREVUS和给予适当支持治疗。对较轻严重的输注反应,处理可能涉及暂时地停止输注,减低输注速率,和/或给予对症治疗。
5.2 感染
与患者服用REBIF或安慰剂比较一个较高的OCREVUS-治疗患者比例经受感染。在RMS 试验,OCREVUS-治疗患者58%经受一次或更多感染与之比较REBIF-治疗患者52%。在PPMS 试验,70%的OCREVUS-治疗患者经受一次或更多感染与之比较用安慰剂患者为68%。OCREVUS增加对上呼吸道感染,下呼吸道感染,皮肤感染,和疱疹-相关感染的风险[见不良反应(6.1)]。在MS患者中OCREVUS不伴随严重感染风险增加。在有一个活动感染患者延迟OCREVUS给药直至感染被解决。
呼吸道感染
与用REBIF或安慰剂患者比较,一个较高比例的OCREVUS-治疗患者经受呼吸道感染。在RMS试验中,40%的OCREVUS-治疗患者经受上呼吸道感染,与之比较33%的REBIF-治疗患者,和8%的OCREVUS-治疗患者经受下呼吸道感染相比较5%的REBIF-治疗患者。在PPMS 试验中,49% OCREVUS-治疗患者经受上呼吸道感染相比较43%的用安慰剂患者和10%的OCREVUS-治疗患者经受下呼吸道感染相比较9%用安慰剂患者。感染占主导地位为轻度至中度和上呼吸道感染和支气管炎组成大多数。.
疱疹
在活性-对照(RMS)临床试验,在OCREVUS治疗患者比REBIF-治疗患者更频地报道疱疹感染,包括带状疱疹 (2.1%相比1.0%),单纯疱疹 (0.7%相比0.1%),口腔疱疹(3.0%相比2.2%),生殖器官疱疹(0.1%相比0%),和疱疹病毒感染(0.1%相比0%)。感染严重程度占主导地位是轻至中度。没有播散性疱疹的报告。
在安慰剂-对照(PPMS)临床试验中,在OCREVUS治疗患者比用安慰剂患者更频地报道口腔疱疹(2.7%相比较0.8%)。
进行性多灶性白质脑病[Progressive Multifocal Leukoencephalopathy(PML)]
PML是一种被John Cunningham(JC)病毒致脑的机遇性病毒感染典型地仅发生在患者是免疫功能低下的,和通常导致死亡或严重的残疾。虽然在OCREVUS临床试验中没有PML的病例被鉴定,在用其他抗-CD20抗体治疗的患者和其他MS治疗曽观察到JC病毒感染导致PML和曽被伴随有些风险因子(如,免疫低下患者,用免疫抑制剂多药治疗)。在提示性PML的第一个体征或症状时,不给OCREVUS和进行一个适当的诊断性评价。临床体征和症状前MRI发现可能是明显。伴随PML典型症状是多种多样的,进程历时数天至数周,和包括机体的一侧进行性软弱或四肢笨拙,视力障碍,和思想,记忆,和方向变化导致混乱和个人性格变化。
乙型肝炎病毒(HBV)再活化
在用OCREVUS治疗MS患者没有乙型肝炎再激活报告。在用其他抗-CD20抗体治疗患者曽发生被HBV再活化所致的暴发型肝炎,肝脏衰竭,和死亡。在用OCREVUS治疗开始前所有患者进行HBV筛选。对被HBsAg和抗-HB测试阳性结果确证有活动性HBV患者不给予OCREVUS。
治疗开始前和期间对表面抗原[HBsAg]阴性和对HB核心抗体阳性[HBcAb+]患者或是HBV[HBsAg+]的携带者,咨询肝脏病专家。.
用其他免疫抑制剂可能增加免疫抑制剂作用的风险
当一种免疫抑制剂治疗后开始OCREVUS或OCREVUS后开始一种免疫抑制剂治疗,考虑对增加免疫抑制效应的潜能[见药物相互作用(7.1)和临床药理学(12.1,12.2)]。未曽研究OCREVUS与其他MS治疗的组合。
疫苗接种
OCREVUS的开始前至少 6周按照免疫准则给予所有免疫接种。
尚未曽研究OCREVUS治疗后用活或活减毒-疫苗疫苗接种的安全性,和建议治疗期间和直至B细胞充分供应前不用活-减毒或活疫苗疫苗接种 [见临床药理学(12.2)]。
对在患者接受OCREVUS活或非-活疫苗接种的影响没有可供利用的数据。.
5.3 恶性病
用OCREVUS可能存在额性病的风险增加。在对照试验中,在OCREVUS-治疗患者恶性病,包括乳癌,发生更频繁。在用OCREVUS治疗女性中6/781发生乳癌和用REBIF或安慰剂治疗的668女性没有。患者应遵循标准乳癌筛选指导准则。
6 不良反应
在说明书的其他节中更详细讨论以下眼中的不良反应:
● 输注反应[见警告和注意事项(5.1)]
● 感染[见警告和注意事项(5.2)]
● 恶性病[见警告和注意事项(5.3)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在1311例患者跨越MS临床研究,其中包括825例患者在活性-对照临床试验在有复发型的MS(RMS)患者和486患者在一项安慰剂-对照研究在有原发性进展型多发性硬化(PPMS)患者曽评价OCREVUS的安全性.
有复发型MS患者不良反应
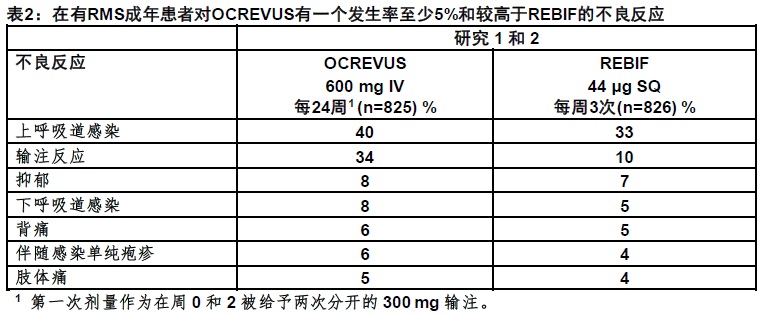
在活性-对照临床试验(研究1和研究2),825例有RMS患者每24周静脉接受OCREVUS 600 mg (初始治疗为作为两次分开的在周0和2给予300 mg输注)[见临床研究(14.1)]。在96-周对照治疗阶段总体暴露为1448患者-年。
在RMS试验最常见不良反应(发生率 ≥ 10%)为上呼吸道感染和输注反应。表2总结了不良反应发生在RMS试验(研究1和研究2).
在有原发性进展型多发性硬化患者不良反应
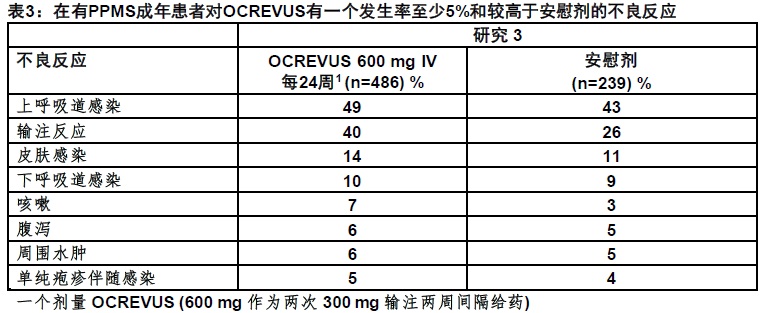
在一项安慰剂-对照临床试验(研究3),总共486有PPMS患者每4周接受静脉给予的一个疗程的OCREVUS(600 mg的OCREVUS给予作为间隔两周的两次300 mg输注)和239患者接受静脉安慰剂[见临床研究(14.2)]。在对照治疗阶段总体暴露为416患者-年,有中位治疗时间3年。
在PPMS试验最常见不良反应(发生率 ≥ 10%)为上呼吸道感染,输注反应,皮肤感染,和下呼吸道感染。表3总结了在PPMS试验(研究3)发生的不良反应。
实验室异常
减低的免疫球蛋白
OCREVUS减低总免疫球蛋白与在IgM水平见到最大下降。在MS临床试验中,对免疫球蛋白减低和风险间没有明显伴随严重感染。
在活性-对照(RMS)试验中(研究1和研究2),在OCREVUS-治疗患者在基线时报告IgG,IgA,和IgM低于正常低限(LLN)患者的比例分别为0.5%,1.5%,和0.1%。治疗后,在96周时报告IgG,IgA,和IgM低于LLN OCREVUS-治疗患者的比例分别为1.5%,2.4%,和16.5%。
在安慰剂-对照(PPMS)试验中(研究3),患者的比例在OCREVUS-治疗患者在基线时报告IgG,IgA,和IgM低于LLN分别为0.0%,0.2%,和0.2%。治疗后在120周时,OCREVUS-治疗患者报告IgG,IgA,和IgM低于LLN的比例分别为1.1%,0.5%,和15.5%。
减低的嗜中性水平
在PPMS 临床试验(研究3)中,在13%的OCREVUS-治疗患者发生嗜中性计数减低与之比较在安慰剂患者中为10%。对给定的用OCREVUS治疗患者,减低的嗜中性计数大多数仅观察到1次和为LLN - 1.5 x 109/L和1.0 x 109/L.间。
总之, 在OCREVUS组1%患者有嗜中性计数低于1.0 x 109/L和这些是不伴随一个感染。
6.2 免疫原性
如同所有治疗性蛋白,有对免疫原性的潜能。免疫原性数据是高度依赖于所用测试方法的敏感性和特异性。此外,在某个测试方法阳性结果的观察发生率可能受几种因素影响,包括 样品处置,采样时机,药物干预,同时药物,和所患疾病。所以,对OCREVUS抗体发生率与对其他产品抗体发生率的比较可能是误导。
在多个时间点(基线和对试验的治疗后每6个月时间)在MS试验患者(研究1,研究2,和研究3) 测试对抗-药抗体(ADAs)。用OCREVUS治疗的1311患者中,12(~1%)被测试对ADAs阳性,其中2患者对中和抗体测试阳性。这些数据不适宜评估ADAs对OCREVUS安全性和疗效发影响。.
7 药物相互作用
7.1 免疫遏制或免疫-修饰治疗
OCREVUS和其他免疫-调节或免疫抑制治疗的同时使用,包括免疫抑制剂量的皮质激素,被预计增加免疫抑制的风险。当免疫抑制治疗与OCREVUS共同给予时考虑相加免疫效应的风险。当从与延长免疫效应药物,例如达利珠单抗[daclizumab],芬戈莫德[fingolimod],那他珠单抗[natalizumab],特立氟胺[teriflunomide],或米托蒽醌[mitoxantrone]转用时,当开始OCREVUS时考虑这些药物的时间和作用模式因为相加性免疫抑制效应[见警告和注意事项(5.2)]。
8 在特殊人群中使用
8.1 妊娠
风险总结
没有在妊娠妇女中伴随OCREVUS的使用对发育风险的适当数据。没有母体暴露于OCREVUS后在人新生儿对B-细胞水平的数据。但是,曽被报道妊娠期间对母亲暴露于其他抗-CD20抗体出生的婴儿中短暂外周B-细胞耗竭和淋巴细胞减少。OCREVUS是一种免疫球蛋白G1亚型的人源化单克隆抗体和已知免疫球蛋白跨越胎盘屏障。Ocrelizumab给予妊娠猴后在剂量相似于或大于临床上使用患者,增加围产期死亡率, B-细胞群的耗竭,肾,骨髓,和在母体缺乏毒性在子代中观察到睾丸毒性。
在美国一般人群中,重大出生缺陷和临床上认可妊娠中流产的估算背景风险分别是2%至4%和15%至20%。不知道适应证人群重大出生缺陷和流产的背景风险。
数据
动物数据
在器官形成期时OCREVUS静脉给予猴后(负荷剂量15或75 mg/kg在妊娠天20,21,和22,接着通过每周剂量20或100 mg/kg),在两种剂量都在胎儿观察到在淋巴组织(脾和淋巴结)中B淋巴细胞耗竭。静脉给予OCREVUS(三次每天负荷剂量15或75 mg/kg,接着用每周剂量20或100 mg/kg)至妊娠猴器官形成阶段自始至终和继续至新生儿阶段导致围产期死亡(有些伴随 细菌感染),肾毒性(肾小球病变和炎症),骨髓中的淋巴滤泡形成,和在新生儿中循环B-淋巴细胞严重的减低。新生儿死亡的原因未确定;但是,两个受影响的新生儿被发现细菌感染。在高剂量时在新生儿中观察到减低的睾丸重量。没有确定一个对发育影响的无效应剂量;在猴中被测试剂量基于mg/kg为推荐人剂量600 mg的2和10倍。
8.2 哺乳
风险总结
对ocrelizumab在人乳中的存在,对哺乳喂养婴儿的影响,或药物对乳汁产生的影响没有数据。Ocrelizumab-治疗猴在乳汁中ocrelizumab被排泄。人IgG是被排泄在人乳汁中,和不知道对ocrelizumab的吸收的潜能导致在婴儿中B-细胞耗竭。哺乳喂养的发育和健康获益应与母亲对OCREVUS的临床需求和哺乳喂养婴儿来自OCREVUS或来自潜在母体情况的任何潜在不良影响一并考虑。
8.3 生殖潜能的女性和男性
避孕
育婴潜能的妇女当接受OCREVUS和OCREVUS末次输注后共6个月应使用避孕[见临床药理学(12.3)]。
8.4 儿童使用
尚未确定在儿童患者中OCREVUS的安全性和有效性。
8.5 老年人使用
OCREVUS的临床研究没有包括充分数量年龄65岁和以上的受试者以确定他们反应是否不同于较年轻受试者。
11 一般描述
Ocrelizumab是一种指向CD20-表达B-细胞的重组人源化单克隆抗体。Ocrelizumab是一种糖基化的免疫球蛋白G1(IgG1)有一个分子质量约145 kDa.
OCREVUS(ocrelizumab)注射液为静脉输注是一种五防腐剂,无菌,透明或略微乳白色,和无色至浅褐色溶液在单次-剂量小瓶中供应。每Ml的溶液含30 mg ocrelizumab,冰醋酸(0.25 mg),聚山梨醇20(0.2 mg),三水乙酸钠(2.14 mg),和海藻糖二水合物(40 mg)在pH 5.3。
12 临床药理学
12.1 作用机制
不知道ocrelizumab在多发性硬化症发挥其治疗作用的精确机制,但是被假设涉及与CD20结合,在前-B和成熟B淋巴细胞上存在的细胞表面抗原。细胞表面与B细胞结合后,ocrelizumab导致抗体-依赖性细胞学细胞溶解和补体-介导溶解。
12.2 药效动力学
对B-细胞计数,使用对CD19+ B-细胞分析因为OCREVUS的存在干扰用CD20分析。用OCREVUS减低在输注后14天血中CD19+ B-6细胞计数。在临床研究中,B-细胞计数上升至高于正常低限(LLN)或高于基线计数间输注的OCREVUS至少一个时间在0.3%至4.1%的患者。在51例患者的临床研究,对B-细胞计数返回至或基线或LLN中位时间为末次OCREVUS输注后72周(范围27-175周)。末次输注后2.5年内,在90%患者中B-细胞计数上升至或基线或LLN。
12.3 药代动力学
在MS临床研究中OCREVUS的药代动力学(PK)拟合一个有时间-依赖清除率的二房室模型。OCREVUS在稳态时的总体暴露(历时24周给药间隔AUC)为3,510 µg/Ml每天。在MS患者临床研究中,ocrelizumab的维持剂量是或600 mg每6个月(RMS患者)或两次300 mg输注被14天分开每6个月(PPMS患者)。均数最高浓度为212 µg/mL在有RMS患者(600 mg输注)和141 µg/Ml在有PPMS患者(两周内两次300 mg输注给药)。Ocrelizumab的药代动力学在400 mg和2000 mg剂量间基本上是线性和剂量正比例。
分布
群体PK估算值的中央食分布容积为2.78 L。周边容积和房室间清除率被估算分别在2.68 L和0.29 L/day。
消除
清除率常数被估算在0.17 L/day,和初始时间-依赖清除率在 0.05 L/day,它下降有一个半衰期33周。末端消除半衰期为26天。
代谢
尚未直接地研究OCREVUS的代谢因为抗体主要地通过降解代谢清除。
特殊人群
肾受损
在临床试验中是包括有轻度肾受损患者。在那些患者中未观察到OCREVUS的药代动力学显著变化。
肝受损
在临床试验中被包括有轻度肝受损患者。在那些患者未观察到OCREVUS的药代动力学显著变化。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未增进行致癌性研究评估OCREVUS的致癌性潜能。
未曽进行研究评估OCREVUS的致突变性潜能。作为一个抗体,OCREVUS预期不与DNA直接相互作用。
在雄性通过静脉注射猴给予ocrelizumab(三次负荷剂量15或75 mg/kg,接着每周剂量20或100 mg/kg)共8周,未观察到对生殖器官的影响。.
利用相同给药方案在雌性猴给予ocrelizumab历时三个月经周期对动情周期也无影响。在猴中测试的剂量,在一个mg/kg基础上是推荐的人剂量600 mg的2和10倍。
14 临床研究
14.1 多发性硬化症的复发型(RMS)
在两项随机化,双盲,双模拟[double-dummy],活性药物对照组[active comparator]-相同设计的对照临床试验,在有RMS患者被治疗共96周(研究1和研究2)证实OCREVUS的疗效。OCREVUS的剂量为600 mg每24周(初始治疗作为间隔2周两次300 mg IV输注给予,随后剂量被作为一个单次600 mg IV输注给予)和每周3次安慰剂皮下注射给予。活性药物对照组REBIF的剂量,为44 µg作为皮下注射每周3次给予和安慰剂IV输注每4周给予。两项研究包括在以前年内曽经受至少1次复发患者,或以前两年内两次复发,和有一个扩展残疾状态量表[Expanded 残疾 Status Scale(EDSS)]评分从0至5.5.
多发性硬化症(MS)的原发进展性型患者被排除。每12周和在怀疑的复发时进行神经学评价。在基线时和在周24,48,和96时进行脑MRIs。.
研究1和研究2的主要结局都是年复发率(ARR)。附加的结局测量包括患者的比例有确症的残疾进展,在周24,48,和96MRI T1钆(Gd)-增强病变的均数,和新或放大MRI T2高信号病变。残疾的进展被定义为来自归因于MS基线EDSS评分增加1点或更多当基线EDSS评分为5.5或较低,或当基线EDSSscore为高于5.5时0.5点或更多。神经学恶化的初始记录后在一个常规时间表访问12周时当EDSS中增加被确证时残疾进展被认为被确证。
为确证残疾进展的分析主要人群是来自研究1和2合并人群。
在研究1中,410患者被随机化至OCREVUS和411至REBIF; OCREVUS-被治疗的11%和REBIF-被治疗患者的17%没有完成96-周双盲治疗阶段。两治疗组间基线人口统计和疾病特征被平衡。在基线时,患者的均数年龄为37岁;66%为女性。从MS诊断至随机化均数时间为3.8年, 在以前年的均数复发为1.3,和均数EDSS评分为2.8;在至研究前2年74%的患者对MS未曽被用一个非-类固醇治疗[steroid therapy]治疗过。在基线时,40%的患者有一个或更多T1 Gd-增强病变(均数1.8)。
在研究2中,417患者被随机化至OCREVUS和418至REBIF;14%的OCREVUS-治疗和23%是REBIF-治疗患者没有完成96-周双盲治疗阶段。两治疗组间基线人口统计和疾病特征被平衡。在基线时,患者的均数年龄为37岁;66%为女性。从MS诊断至随机化均数时间为4.1年,在以前年的均数复发为1.3,和均数EDSS评分为2.8;74%的患者在研究的前2年中未曽为MS用一个非-类固醇治疗。在基线时,40%的OCREVUS-治疗患者有一个或更多T1 Gd-增强病变(均数1.9)。
在研究1和研究2,与REBIF比较OCREVUS显著地降低年复发率和有在12周在发作后被确证的残疾进展患者的比例。在表4和图1中展示对研究1和研究2结果。.
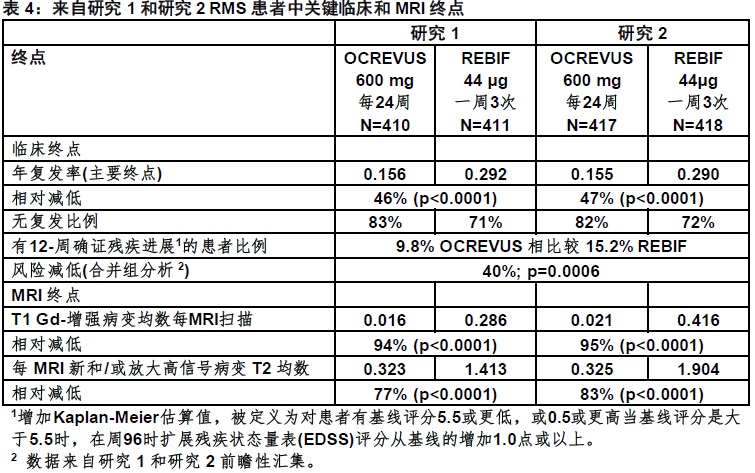
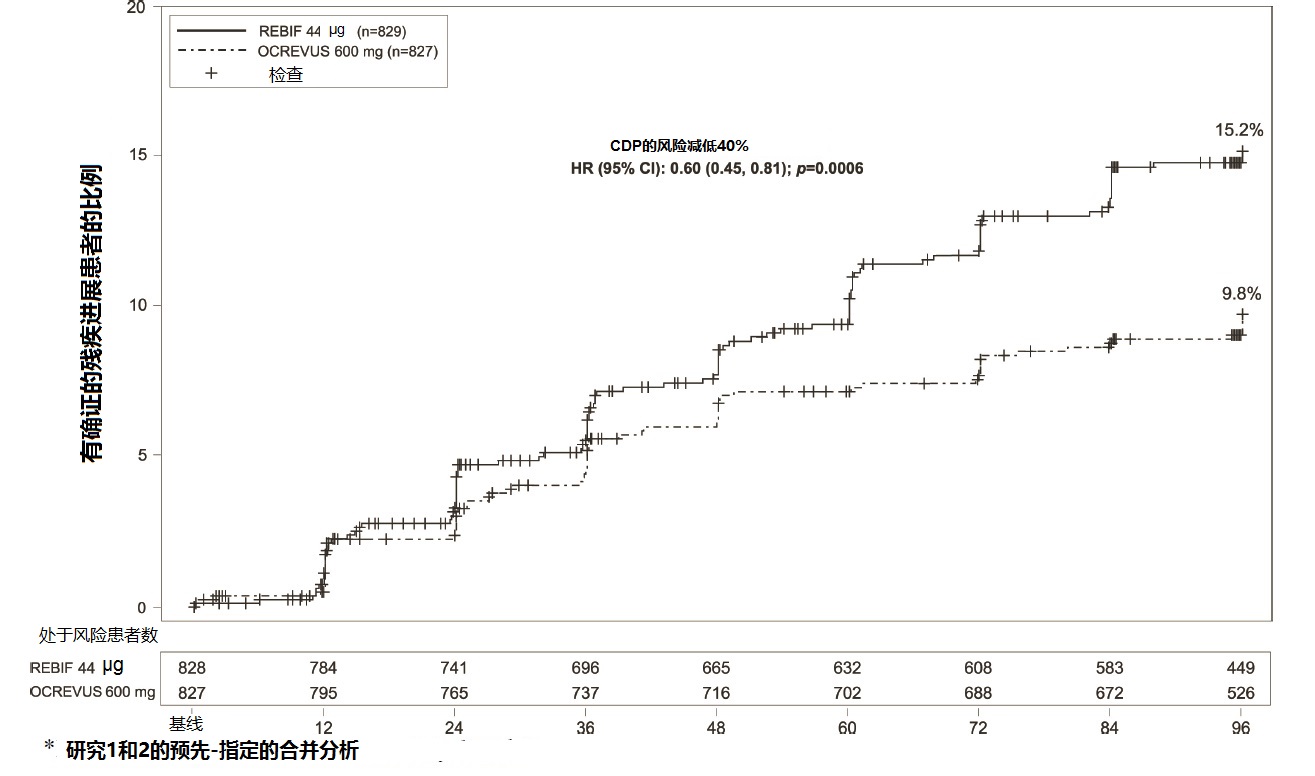
图1在合并的研究1和2在有RMS患者(合并的ITT人群)双盲治疗阶段期间发生神经血恶化的有初始事件至确症残疾进展的发作持续时间的Kaplan-Meier作图*共至少12周。
研究1和研究2的开拓性亚组分析中,在男性和女性患者中OCREVUS对年复发率和残疾进展的影响相似。
14.2 原发进展型多发性硬化症[Primary Progressive Multiple Sclerosis](PPMS)
研究3是一项在有PPMS患者随机化,双盲,安慰剂-对照临床试验。患者被随机化2:1至接受或OCREVUS 600 mg或安慰剂作为间隔2周两次300 mg静脉输注每24周共至少120周。选择标准要求一个基线EDSS的3至6.5和一个评分2或较大的对EDSS椎体功能系统由于下肢发现。每12周进行神经学评估。在基线时和在周24,48,和120得到一个MRI扫描。
在研究3中,主要结局是归因于被确证MS是存在于下一次神经学评估至少12周以后至残疾进展的发作时间。残疾进展发生当EDSS评分从基线EDSS增加1点或更多如基线EDSS为5.5 点或更低,或0.5点或更多如基线EDSS是超过5.5点。在研究3中,被确证的残疾进展也被认为已经发生学评估如果患者有残疾进展的发作终止参与在研究中下一次评估前。附加结局测量包括25英尺步行时间,和在T2高信号病变体积中百分率变化。.
研究3随机化488患者至OCREVUS和244至安慰剂;21%的OCREVUS-治疗患者和34%的安慰剂-治疗患者没有完成试验。治疗组间基线人口统计和基本特征被平衡。在基线时,患者的均数年龄为45;49%为女性。自症状发作均数时间为6.7年,均数 EDSS评分为 4.7,和在基线时26% 有一个或更多 T1 Gd-增强病变;88%的患者以前没有为MS用一种非-类固醇治疗。对OCREVUS-治疗患者比对安慰剂-治疗患者在12周时发作后至被确证残疾进展的发作时间是显著地较长(见图2)。在 表5和图2中展示对研究3结果.
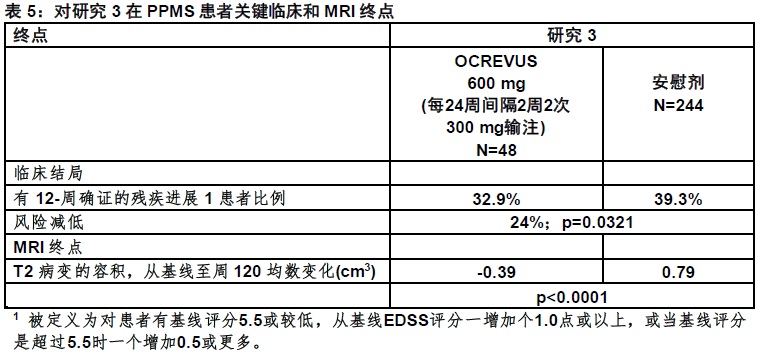
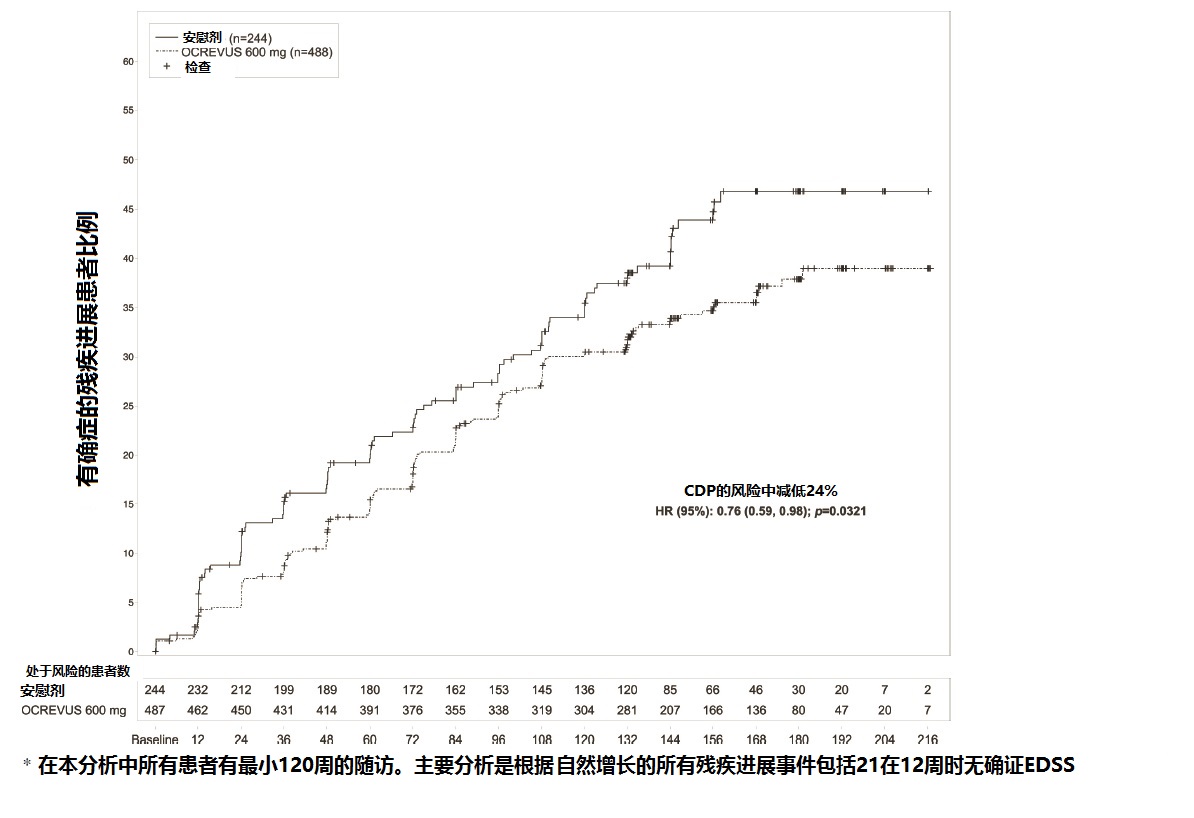
图2 在研究3中双盲治疗阶段时,至确证的残疾进展持续共至少12周有神经学恶化的初始事件发作的时间的Kaplan-Meier作图*
在研究3总体人群中,在12周时有确证的25英尺步行时间恶化20%患者的比例在OCREVUS-治疗患者为49%,与之比较在安慰剂-治疗患者中59%(25%风险减低)。
在研究3的探索性亚组分析中,在12周发作后在OCREVUS-治疗患者和安慰剂-治疗患者有确证的残疾进展女性患者比例是相似(在各个组约36%)。在男性患者中,在12周发作后有确证的残疾进展患者的比例在OCREVUS-治疗患者为约30%和在安慰剂治疗患者为43%。临床和MRI终点在总体人群中在数字上一般地有利于OCREVUS,和在男性和女性患者两者显示相似趋向,包括年复发率,在T2病变体积中变化,和新或放大T2病变数。
16 如何供应/贮存和处置
OCREVUS(ocrelizumab)注射液是一种无防腐剂,无菌,透明或略微乳白色,和无色至浅褐色溶液作为含一个300 mg/10 mL(30 mg/mL)单次-剂量小瓶纸盒供应(NDC 50242-150-01)。
贮存OCREVUS小瓶在2°C–8°C(36°F–46°F)在外纸盒以避光保护。不要冻结或摇晃。
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(用药指南).
输注反应
告知患者关于输注反应的体征和症状,和输注反应可能发生于输注后至24小时。建议患者对输注反应的体征或症状立即联系他们的卫生保健提供者[见警告和注意事项(5.1)]。
感染
建议患者治疗期间或末次剂量后感染的任何体征联系他们的卫生保健提供者[见临床药理学(12.2)]。体征包括发热,发冷,不断咳嗽,或疱疹的迹象例如唇疱疹,带状疱疹,或生殖器疱疹[见警告和注意事项(5.2)]。
建议患者与OCREVUS相似药物曽出现进行性多灶性白质脑病[Progressive Multifocal Leukoencephalopathy(PML)]和用OCREVUS可能出现。告知患者PML其特征是缺乏进展,通常导致死亡或严重的失能历时数周或数月。指导患者如果他们发生任何症状提示PML联系他们的医生的重要性。告知患者伴随PML典型症状是多种多样的,进展历时数天至数周,和包括进行性虚弱在机体的一侧或四肢笨拙[clumsiness of limbs],视力障碍,和思想,记忆和方向变化导致混乱和个人性格变化[见警告和注意事项(5.2)]。
忠告患者OCREVUS可能致乙型肝炎再活化和如他们是处于风险将需要监视[见警告和注意事项(5.2)]。
疫苗接种
建议患者OCREVUS的开始前至少6周完成任何需要的疫苗接种。
OCREVUS治疗期间建议不给予活-减毒或活疫苗和直至B-细胞恢复[见警告和注意事项(5.2)].
恶性
忠告患者用OCREVUS恶性病风险可能存在增加,包括乳癌。
建议患者他们应遵循标准乳癌筛选指导[见警告和注意事项(5.3)]。
妊娠
指导患者如她们是妊娠或计划成为妊娠当服用OCREVUS他们应告知她们的卫生保健提供者[见妊娠(8.1)]。

