批准日期:2017年3月28日;公司:Sanofi和Regeneron Pharmaceuticals,Inc.
FDA的药品评价和研究中心中药品评价III部办公室主任Julie Beitz,M.D.说:“Dupixent 的FDA批准显示我们的承诺批准新和创新治疗对有皮肤病患者,” “湿疹对患者可能致显著皮肤刺激和不适,所以对患者有各种可得到的治疗选择很重要,包括哪些患者其疾病不能被局部治疗控制。” 优先审评和突破性治疗指定。
https://www.regeneron.com/sites/default/files/Dupixent_FPI.pdf
处方资料重点
这些重点不包括安全和有效使用DUPIXENT需所有资料。请参阅DUPIXENT完整处方资料。
DUPIXENT®(dupilumab)注射液,为皮下使用
美国初次批准: 2017
适应证和用途
DUPIXENT是一种白介素4受体α拮抗剂,表明:
1、 用于治疗12岁及以上患有中度至重度的特应性皮炎的患者,这些患者的疾病无法通过局部处方疗法或在不建议采用这些疗法的情况下得到充分控制。DUPIXENT可与或不与局部皮质类固醇一起使用。 (1.1)
2、作为嗜酸性表型或口服糖皮质激素依赖型哮喘的12岁及以上的中重度哮喘患者的附加维持治疗。 (1.2)
使用限制
不适用于缓解急性支气管痉挛或哮喘状态。 (1.2)
3、作为控制不当的慢性鼻鼻窦炎伴鼻息肉(CRSwNP)的成年患者的附加维持治疗。 (1.3)
剂量和给药方法
1、特应性皮炎:
青少年不到60kg:首次400mg(2次200mg),随后每隔一周200mg;
青少年体重达到60kg或者所有成年人:首次600mg(2次300mg),随后每隔一周300mg;
2、哮喘
成人和青少年(12岁以上)的DUPIXENT推荐剂量为:
o初始剂量为400毫克(两次200毫克注射),然后每两周给予200毫克或
o初始剂量为600毫克(两次300毫克注射),然后每两周给予300毫克
o对于需要同时口服皮质类固醇激素或合并并发中度至重度特应性皮炎的患者,DUPIXENT的起始剂量为600 mg,然后每两周给予300 mg
3、慢性鼻鼻窦炎伴鼻息肉
成人患者的DUPIXENT推荐剂量为每两周300 mg。
剂型和规格
● 注射液:300 mg/2 mL溶液在一个单次-剂量预装注射器带针罩。(3)
● 注射液:200 mg/1.14 mL溶液在一个单次-剂量预装注射器。(3)
禁忌证
对DUPIXENT或其赋形剂的任何已知过敏性。(4)
警告和注意事项
●超敏反应:服用DUPIXENT后发生超敏反应(荨麻疹,皮疹,结节性红斑,过敏反应和血清病)。万一发生超敏反应,请中止DUPIXENT。 (5.1)
●结膜炎和角膜炎:患者应向医护人员报告新的发作或眼部症状恶化。 (5.2)
●嗜酸性疾病:警惕血管性皮疹,恶化的肺部症状和/或神经病变,尤其是口服皮质类固醇激素减少时。 (5.3)
●减少皮质类固醇剂量:不要在开始使用DUPIXENT治疗后突然终止全身,局部或吸入性皮质类固醇。酌情逐渐减少类固醇。 (5.5)
●寄生虫(蠕虫)感染:在开始用DUPIXENT治疗之前,应治疗已存在蠕虫感染的患者。如果患者在接受DUPIXENT治疗时被感染并且对抗蠕虫药治疗无反应,请停止使用DUPIXENT治疗直至感染消退。 (5.7)
不良反应
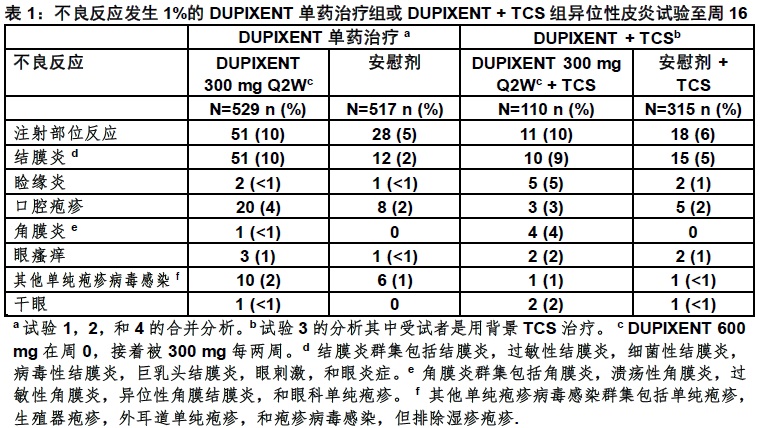
特应性皮炎:最常见的不良反应(发生率≥1%)是注射部位反应,结膜炎,睑缘炎,口腔疱疹,角膜炎,眼瘙痒,其他单纯疱疹病毒感染和干眼症。 (6.1)
哮喘:最常见的不良反应(发生率≥1%)是注射部位反应,口咽痛和嗜酸性粒细胞增多。 (6.1)
慢性鼻鼻窦炎伴鼻息肉:最常见的不良反应(发生率≥1%)是注射部位反应,嗜酸性粒细胞增多,失眠,牙痛,胃炎,关节痛和结膜炎。 (6.1)
报告怀疑不良反应,联系Regeneron电话1-855-395-3248或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
活疫苗:用DUPIXENT避免使用活疫苗。(7.1)
完整处方资料
1 适应证和用途
1.1特应性皮炎
DUPIXENT用于治疗中度至重度的特应性皮炎的12岁及12岁以上的患者,这些患者的疾病无法通过局部处方疗法或在不推荐使用的方式进行适当控制。 DUPIXENT可与或不与局部皮质类固醇一起使用。
1.2哮喘
DUPIXENT被指定为患有嗜酸性表型或口服糖皮质激素依赖型哮喘的12岁及以上的中重度哮喘患者的补充维持治疗。
使用限制
DUPIXENT不适用于缓解急性支气管痉挛或哮喘状态。
1.3慢性鼻鼻窦炎伴鼻息肉
DUPIXENT被指定为控制不充分的慢性鼻鼻窦炎伴鼻息肉(CRSwNP)的成年患者的附加维持治疗。
2 剂量和给药方法
2.1 剂量
1、特应性皮炎:
青少年不到60kg:首次400mg(2次200mg),随后每隔一周200mg;
青少年体重达到60kg或者所有成年人:首次600mg(2次300mg),随后每隔一周300mg;
2、哮喘
成人和青少年(12岁以上)的DUPIXENT推荐剂量为:
o初始剂量为400毫克(两次200毫克注射),然后每两周给予200毫克或
o初始剂量为600毫克(两次300毫克注射),然后每两周给予300毫克
o对于需要同时口服皮质类固醇激素或合并并发中度至重度特应性皮炎的患者,DUPIXENT的起始剂量为600 mg,然后每两周给予300 mg
3、慢性鼻鼻窦炎伴鼻息肉
成人患者的DUPIXENT推荐剂量为每两周300 mg。
2.2 重要的给药指导
DUPIXENT是意向在一位卫生保健提供者指导下使用。一位患者可能自身注射DUPIXENT 在受训练用预充填注射器在皮下注射技术。对患者和/或护理人员对 制备和给予DUPIXENT前使用按照“使用指南”提供适当训练。
对初始600 mg剂量,在不同注射部位给予两次DUPIXENT 300 mg的每一次注射。
给予皮下注射至大腿或腹部为肚脐周围2英寸(5厘米)。如一位护理人员给予注射也可使用上臂。
每次注射旋转注射部位。不要注射DUPIXENT至脆弱,受损,瘀伤,或瘢痕的皮肤。对DUPIXENT(即,预充填注射器有或无针头护帽)有两个代表。对每个代表DUPIXENT “使用指南”包括对DUPIXENT制备和给药的更详细指导[见使用指南]。
2.3 制备为预充填注射器有或无针头护帽DUPIXENT的使用
注射前,从冰箱取出DUPIXENT预充填注射器和允许DUPIXENT达到室温(45分钟)取下针头帽。
给药前视力观察DUPIXENT有无颗粒物质和变色。DUPIXENT是透明至略微乳光,无色至浅换色溶液。如液体含可见颗粒物质,变色云雾状不要使用(除了透明略有乳光,无色至浅换色)。DUPIXENT不含防腐剂;所以,遗弃在预充填注射器保留的任何未使用产品。
3 剂型和规格
DUPIXENT是一个透明至略微乳白色,无色至浅黄色溶液可得到如:
● 注射液:300 mg/2 mL在一个单次-剂量预装注射器带针帽
● 注射液:200 mg/1.14 mL在一个单次-剂量预装注射器
4 禁忌证
DUPIXENT是对dupilumab或其赋形剂的任何已知超敏性患者禁忌[见警告和注意事项(5.1)]。
5 警告和注意事项
5.1 超敏性
在临床试验中接受DUPIXENT低于1%的受试者报告超敏性反应,包括普遍性荨麻疹和血清病或血清病样反应,两例受试者经受血清病或血清病-样单药是伴随高滴度的对dupilumab抗体[见不良反应(6.2)]。如发生一个临床上显著超敏性反应。开始适当治疗和终止DUPIXENT[见不良反应(6.1,6.2)]。
5.2 结膜炎和角膜炎
在接受DUPIXENT受试者更频发生结膜炎和角膜炎。结膜炎是最频报道的眼疾病。大多数有结膜炎受试者在治疗阶段期间恢复或正在恢复[见不良反应(6.1)]。
在16-周单药治疗试验中在 <1%的DUPIXENT组报道角膜炎(1每100受试者-年)和在0%安慰剂组(0每100受试者-年)。在52-周DUPIXENT + 局部皮质激素(TCS)试验,角膜炎被报道在4%的DUPIXENT + TCS组(12每100受试者-年)和在0%的安慰剂 + TCS组(0每100受试者-年)。大多数有角膜受试者炎恢复或治疗阶段期间正在恢复[见不良反应(6.1)]。
建议患者报告新发作或恶化的眼症状至他们的卫生保健提供者。
5.3嗜酸性条件
接受哮喘治疗的患者可能会出现严重的全身性嗜酸性粒细胞增多症,有时表现出嗜酸性粒细胞性肺炎或血管炎的临床特征,并伴有嗜酸性粒细胞瘤伴多发性血管炎,这些病症通常需要全身性糖皮质激素治疗。这些事件可能与口服糖皮质激素治疗的减少有关。医生应警惕嗜酸性粒细胞增多症患者的血管性皮疹,肺部症状恶化,心脏并发症和/或神经病变。在参与哮喘发展计划的成年患者中报告了嗜酸性粒细胞性肺炎病例,在参与哮喘发展计划的成年患者以及合并哮喘的成年患者中,DUPIXENT报道了与嗜酸性肉芽肿性多血管炎相一致的血管炎病例。 CRSwNP开发计划中的病态哮喘。 DUPIXENT与这些条件之间的因果关系尚未建立。
5.4急性哮喘症状或疾病恶化
DUPIXENT不应用于治疗急性哮喘症状或急性发作。 不要使用DUPIXENT治疗急性支气管痉挛或哮喘状态。 如果开始使用DUPIXENT治疗后哮喘仍未得到控制或恶化,患者应寻求医疗建议
5.5减少皮质类固醇剂量
开始使用DUPIXENT进行治疗时,请勿突然终止全身,局部或吸入皮质类固醇激素治疗。 如果合适,应逐步减少皮质类固醇激素剂量,并在医生的直接监督下进行。 皮质类固醇剂量的减少可能与全身性戒断症状和/或先前被全身性皮质类固醇疗法抑制的暴露状况有关。
5.6 共存性哮喘
在哮喘的治疗中未曽确定DUPIXENT的安全性和疗效。建议有共存性哮喘患者在没有咨询他们的医生时不要调整或停止他们的哮喘治疗。
5.7 寄生虫(蠕虫)感染
在临床研究中有已知蠕虫感染的患者被排除参加入。不知道DUPIXENT是否将影响对蠕虫感染的免疫反应。
6 不良反应
在说明书其他处更详细讨论以下不良反应:
● 超敏性[见警告和注意事项(5.1)]
● 结膜炎和角膜炎[见警告和注意事项(5.2)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
三项随机化,双盲,安慰剂-对照,多中心试验(试验1,2,和3)和一项剂量范围试验(试验4) 在有中度-至严重异位性皮炎受试者评价DUPIXENT的安全性。安全性人群有中位年龄38 岁;41%受试者为女性,67%为白种人,24%为亚裔,和6%为黑种人;按照共存性条件,48%受试者有哮喘,49%有过敏性鼻炎,37%有食物过敏性,和27%有过敏性结膜炎。在这些4项试验中,1472受试者被用皮下注射DUPIXENT治疗,有或无同时局部皮质激素(TCS)。
对中度-至-严重异位性皮炎发展计划中总共739 受试者被用DUPIXENT治疗共至少1年。试验1,2,和4与安慰剂比较DUPIXENT单药治疗的安全性至周16。
试验3与安慰剂 + TCS比较DUPIXENT + TCS的安全性至周52。
周0至16(试验1至4):
在DUPIXENT单药治疗试验(试验1,2,和4至)周16,因为不良事件终止治疗受试者的比例在DUPIXENT 300 mg Q2W和安慰剂组两者都为1.9%。
表1总结了不良反应发生在一个率至少1%在DUPIXENT 300 mg Q2W单药治疗组,和在DUPIXENT + TCS组,所有在头16周治疗期间在一个比他们的相应对比药组一个较高率。
至周52安全性(试验3):
在DUPIXENT有同时TCS试验中(试验3至周52,因为不良事件终止治疗受试者的比例为1.8%在DUPIXENT 300 mg Q2W + TCS 组和7.6%在安慰剂 + TCS组。两例受试者因为不良反应终止DUPIXENT:异位性皮炎(1受试者)和剥脱性皮炎(1受试者)。
DUPIXENT + TCS至周52的安全性图形一般地与在周16时观察到安全性图形一致。
特异性不良反应
结膜炎
同时治疗试验52-周治疗阶段期间(试验3),在16%的DUPIXENT 300 mg Q2W + TCS组(20每100受试者-年)报道结膜炎和安慰剂 + TCS组为9%(10每100受试者-年)[见警告和注意事项(5.2)]。
湿疹疱疹和带状庖疹
在安慰剂和DUPIXENT组湿疹疱疹率为相似。
在16-周单药治疗试验在<0.1%的DUPIXENT组(<1每100受试者-年)报道带状庖疹和在<1%的安慰剂组(1每100受试者-年)。在52-周DUPIXENT + TCS试验,带状庖疹被报道在1%的DUPIXENT + TCS组(1每100受试者-年)和安慰剂 + TCS组为2%(2每100受试者-年)。
超敏性反应
在<1%的DUPIXENT-治疗受试者报道超敏性反应。这些包括血清病反应,血清病-样反应,和普遍性荨麻疹[见禁忌证(4),警告和注意事项(5.1),和不良反应(6.2)]。
嗜酸性
在单药治疗试验中DUPIXENT-治疗受试者与用安慰剂治疗受试者比较在嗜酸性计数有一个从基线更大的均数初始增加。周16嗜酸性计数下降至接近基线水平。在52-周DUPIXENT + TCS 试验没有观察到嗜酸性中初始增加。
在试验1,2,和3,在DUPIXENT和安慰剂组治疗出现的嗜酸性(500 细胞/µL)的发生率相似。在试验 1,2,和3,治疗-出现的嗜酸性5000 细胞/µL)被报道在<1%的DUPIXENT-治疗患者而在安慰剂治疗患者中没有。在大多数病例,研究治疗期间嗜酸性计数下降至接近基线。
6.2 免疫原性
如同所有治疗的白,有免疫原性潜能。抗体形成的检测是高度依赖于分析的灵敏度和特异性。此外,在某种分析中观察到的抗体阳性发生率(包括中和抗体)可能是受几种因素影响,包括分析方法学,样品处置,采样时机,同时药物,和所患疾病。因为这些理由,对在下面研究中描述dupilumab抗体的发生率与其他研究或其他产品抗体的发生率的比较可能是误导。
有异位性皮炎接受DUPIXENT 300 mg Q2W共16周受试者约7%发生对dupilumab抗体。受试者发生对dupilumab抗体,约30%(所有受试者接受DUPIXENT的2%)有抗体被分类为中和。
有异位性皮炎接受DUPIXENT 300 mg Q2W + TCS共52周受试者,约7%发生对dupilumab抗体和约2%有持续抗体反应,被定义为有至少2次连续阳性基线后样品。发生对dupilumab抗体受试者,约14%(所有受试者接受DUPIXENT + TCS的1%)有抗体被分类为中和。
在接受DUPIXENT受试者中,对dupilumab抗体的发生发展是伴随较低血清dupilumab浓度[见临床药理学(12.3)]。在安慰剂或安慰剂 + TCS组分别在约2%和8%的有异位性皮炎受试者被检测到对dupilumab抗体。在DUPIXENT和安慰剂受试者两者被检测到抗体滴度一般地是低。DUPIXENT治疗期间两例受试者发生血清病或血清病-样反应和对dupilumab抗体的高滴度[见警告和注意事项(5.1)]。
7 药物相互作用
7.1 活疫苗
在用DUPIXENT治疗患者中避免使用活疫苗.
7.2 非-活疫苗
在一项研究其中有异位性皮炎受试者每周1次被治疗共16 周用300 mg的dupilumab(推荐给药频度两倍)评估对疫苗接种的免疫反应。DUPIXENT给药12周后,受试者被用一种Tdap疫苗(Adacel®)和一种脑膜炎球菌多糖菌苗(Menomune®)接种。4 周以后被评估对破伤风类毒素和C群脑膜炎球菌 [serogroup C meningococcal]多糖抗体反应。在dupilumab-治疗和安慰剂-治疗受试者对破伤风疫苗和脑膜炎球菌多糖菌苗两者抗体反应相似。没有评估对 Adacel和Menomune疫苗的其他活性成分的免疫反应。
7.3 与CYP450底物相互作用
CYP450酶的形成可能被慢性炎症期间某些细胞因子增加水平改变(如,IL-1,IL-4,IL-6,IL-10,IL-13,TNFα和IFN)。因此,DUPIXENT,IL-4受体α的一种拮抗剂,可能调节CYP450酶的形成。所以,DUPIXENT开始或终止在患者正在接受同时药物是CYP450底物,尤其是有狭窄治疗指数药物,考虑监视效应(如,对华法林[warfarin])或药物浓度(如,对环孢霉素[cyclosporine])和考虑CYP45底物剂量的修饰。
8 在特殊人群中使用
8.1 妊娠
风险总结
对在妊娠妇女中DUPIXENT使用没有可供利用数据以告知任何药物相关风险。已知人IgG 抗体跨越胎盘屏障:所以,DUPIXENT可能从母亲传输给发育中胎儿。在一项增强的围产期发育研究中,妊娠猴皮下给予一种同种抗体后生下子代中没有观察到不良发育影响对白介素-4-受体α(IL-R during 器官形成期至分娩期间在剂量至10-倍最大推荐人剂量(MRHD)[见数据]。不知道对适应证人群重大出生缺陷和流产估算的背景风险。所有妊娠有出生缺陷,丢失或其他不良结局的背景风险。在美国一般人群,重大缺陷和临床上妊娠中流产的估算背景风险分别是2%至4%和15%至20%。
数据
动物数据
在一项增强的围产期发育毒性研究,妊娠食蟹猴[cynomolgus monkeys]被每周给予皮下剂量的对IL-4Rα同种抗体至10倍的MRHD(在一个mg/kg基础的100 mg/kg/week)从器官形成期至分娩。未观察到在子代从出生至6个月龄,对胚胎胎儿毒性或畸形,或形态学,功能或免疫发育治疗相关不良效应。
8风险总结
没有在人乳汁中存在,对哺乳喂养婴儿的影响灭活对乳汁产生影响的数据。已知人IgG在人乳汁中存在。不知道局部胃肠道和有限全身暴露对dupilumab哺乳喂养婴儿。哺乳喂养婴儿的发育和健康获益应与母亲对DUPIXENT临床需求和哺乳喂养儿童来自DUPIXENT或自. 母体潜在情况任何潜在不良影响一并考虑
8.4 儿童使用
尚未确定在儿童患者(<18岁)中安全性和疗效。
8.5 老年人使用
在一项剂量-范围研究和安慰剂-对照试验中1472例有异位性皮炎受试者暴露于DUPIXENT,其中67例受试者为65岁或以上。虽然老年和较年轻受试者间未观察到安全性和疗效差别,年龄65和以上受试者数量不够充分不能确定他们反应是否不同于较年轻受试者[见临床药理学(12.3) ].
10 药物过量
对DUPIXENT药物过量没有特异性治疗。在过量剂量的事件中,监视患者不良反应的任何体征或症状和立即开始适当对症治疗。
11 一般描述
Dupilumab,一种白介素-4受体α拮抗剂,是一种IgG4亚类别人单克隆抗体结合至IL-Rα 亚单位和抑制IL-4和IL-13信号。Dupilumab有一个约分子量147 kDa。
Dupilumab是通过重组DNA技术在中国仓鼠卵巢细胞悬液培养生产。DUPIXENT(dupilumab) 注射液是作为一个无菌,无防腐剂,透明至略微乳白色,无色至浅换色溶液为皮下注射供应。DUPIXENT被提供作为一个单次-剂量预充填注射器有或无针头护帽在一个2.25 mL硅型-1透明玻璃注射器。针帽不是用天然橡胶乳胶制造。每个预充填注射器输送300 mg dupilumab 在2 mL中,其中还含盐酸L-精氨酸(10.5 mg),L组氨酸(6.2 mg),聚山梨醇80(4 mg),醋酸钠(2 mg),蔗糖(100 mg),和注射用水,pH 5.9。
12 临床药理学
12.1 作用机制
Dupilumab是一个人单克隆IgG4抗体抑制白介素-4(IL-4)和白介素-13(IL-13)信号通过特异性地结合至被IL-4和IL-13受体复合物共享的IL-Rα亚单位。Dupilumab inhibits通过型I受体抑制IL-4信号和IL-4和IL-13信号两者通过型II受体。阻断IL-R与dupilumab抑制IL-4和IL-13细胞因子-诱导的反应,包括促炎性细胞因子,趋化因子和IgE的释放。
12.2 药效动力学
Dupilumab治疗后与受体阻断一致,血清IL-4和IL-13的水平被增加。不知道药效动力学活性和dupilumab发挥其临床作用的机制间相互关系。
12.3 药代动力学
吸收
一个初始皮下(SC)剂量600 mg后,dupilumab在药后约一周达到峰均数±SD浓度(Cmax) 70.1±24.1 µg/mL。给予600 mg开始剂量和300 mg剂量或每周(推荐给药频数两倍)或每隔周后周16实现稳态浓度。跨越临床试验,均数±SD稳态低谷浓度范围从73.3±40.0 µg/mL至79.9±41.4 µg/mL对300 mg给予每2周和从173±75.9 µg/mL至193±77.0 µg/mL对300 mg给予每周。一次SC剂量后dupilumab的生物利用度估算是64%。
分布
估算的分布总体积为约4.8±1.3 L。
消除
Dupilumab的代谢途径特征尚未描述。作为一个人单克隆IgG4抗体,dupilumab被预计将通过内源性IgG相同的方式被降解至小肽和氨基酸。在末次稳态剂量300 mg Q2W或300 mg QW dupilumab后至不能检测的浓度(<78 ng/mL)中位时间分别为10和13周。
剂量线性
Dupilumab表现出非线性靶向-介导的药代动力学有暴露增加在大于剂量-正比例方式。当一个单次剂量dupilumab的剂量从75 mg增加至600 mg(即,0.25倍至2-倍推荐剂量)后全身暴露增加30-倍。
体重
在有较高体重受试者中Dupilumab谷浓度是较低。
免疫原性
对dupilumab抗体的发生发展是伴随较低血清dupilumab 浓度。一个少数受试者有高抗体滴度也没有可检测到的血清dupilumab浓度。
特殊人群
老年人
在受试者是65岁和以上患者,对300 mg给药每2周和每周,dupilumab的稳态谷浓度的均数±SD分别为69.4±31.4 µg/mL和166±62.3 µg/mL。在这个人群无推荐的剂量调整。
肾或肝受损
未进行肝或肾受损对dupilumab的药代动力学的影响的正式试验。
药物相互作用研究
未曽用DUPIXENT进行药物相互作用研究。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未曽进行动物研究以评价dupilumab致癌性或致突变性潜能。
在性成熟小鼠皮下地给予对IL4-Rα同种抗体剂量至200 mg/kg/周,未观察到对生育力参数影响例如生殖器官,月经周期长度,或精子分析。
14 临床研究
三项随机化,双盲,安慰剂-对照试验(试验1,2,和3)总共纳入2119例18岁和以上有中度-至-严重异位性皮炎(AD)用局部药物不适当地控制受试者。疾病的严重程度被一位研究者的全面评估(IGA)在AD病变的总体评分严重程度刻度0至4上为≥ 3,一个湿疹面积和严重程度指数(EASI)评分在一个刻度0至72,为≥16;和机体涉及最小面积≥10%。在基线时,59%的受试者为男性,67%为白种人,52%的受试者有一个基线IGA评分为3(中度AD),和48%的受试者有一个基线IGA 为4(严重AD。基线均数EASI评分为33和基线每周平均峰瘙痒数字刻度[Numeric Rating Scale(NRS)]为7在一个刻度为0-10。
在所有三项试验,在DUPIXENT组中受试者接受皮下注射DUPIXENT 600 mg在周0时,接着每隔周(Q2W)300 mg。在单药治疗试验(试验1和2),受试者接受DUPIXENT或安慰剂16周。
在同时治疗试验(试验 3),受试者接受DUPIXENT或安慰剂与同时局部皮质激素(TCS)和当需要局部钙调神经磷酸酶抑制剂[calcineurin inhibitors]仅对问题区域,例如面,颈,两面间的[intertriginous]和生殖器区[genital areas]共52周。
所有三项试验评估主要终点,在有一个IGA 0(清除)或1(几乎清除) 受试者比例从基线至周16变化和至少一个2-点改善受试者比例变化。其他终点包括EASI-75(在EASI评分从基线改善至少75%)受试者比例,和痒中减低当被定义在峰瘙痒NRS从基线至周16至少一个4点改善。
在周16临床反应(试验 1,2,和3)
表2中展示DUPIXENT单药治疗试验(试验1和2)和DUPIXENT与同时TCS试验(试验3) 的结果。
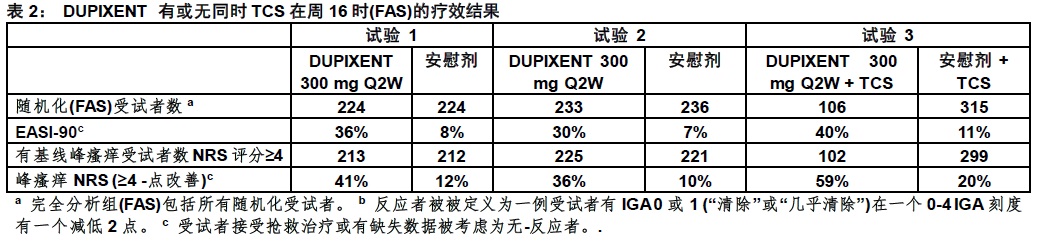
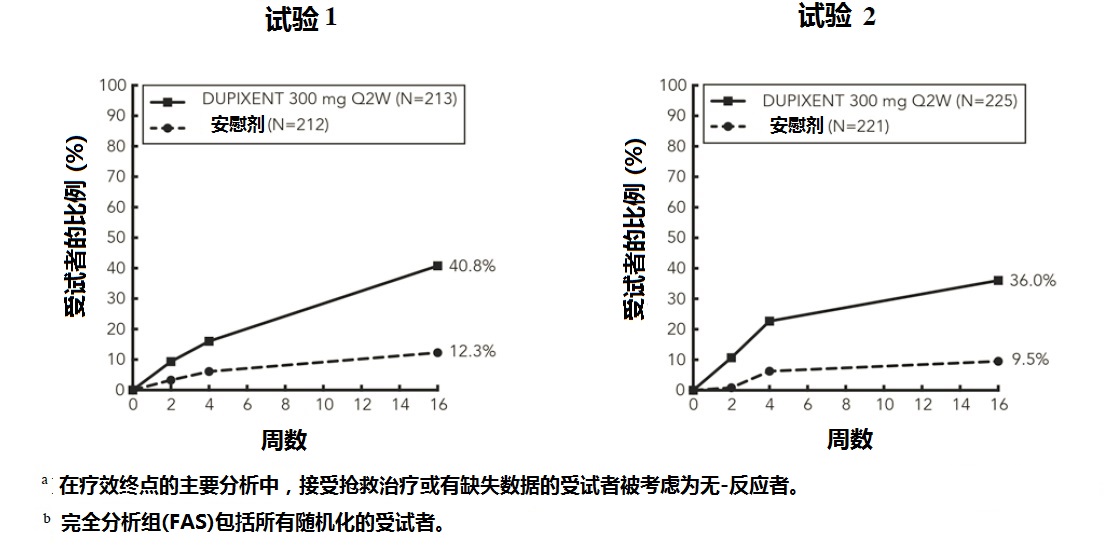
图1:在试验1a和试验2a 研究中对瘙痒NRS有≥4-点改善受试者的比例(FAS)b
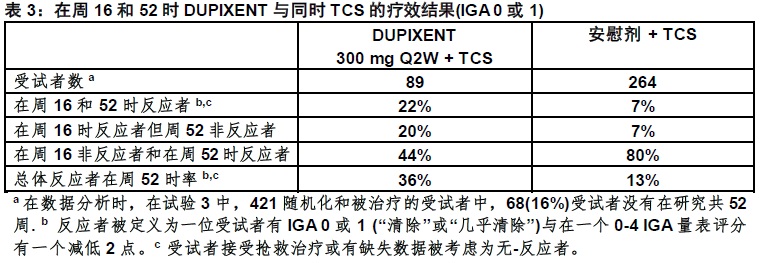
在试验3中,在数据分析时421受试者中,353曽被用研究共52周。这些353受试者中,在周52反应者代表维持他们的疗效从周16受试者的混合(如,在周16时53%的DUPIXENT IGA 0或1 反应者在周52时保留为反应者)和在周16是非-反应者受试者以后对治疗反应(如,在周16时,24%的DUPIXENT IGA 0或1的非-反应者在周52时成为反应者)。在表3中展示在DUPIXENT与同时TCS试验(试验3) 353受试者支持性分析的结果。
在亚组治疗效应(体重,年龄,性别,种族,和治疗前,包括免疫抑制剂)在试验1,2,和3是一般地与总体研究人群结果一致。
在试验 1,2,和3,一项DUPIXENT的第三项随机化治疗臂300 mg QW没有显示超过DUPIXENT 300 mg Q2W附加治疗获益。
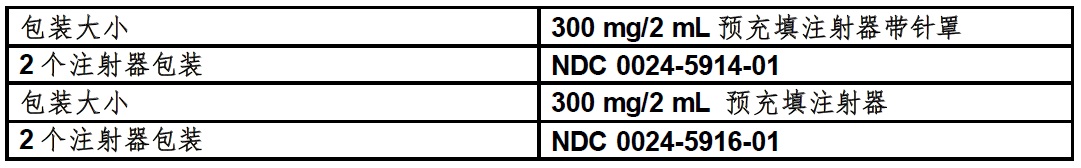
16 如何供应/贮存和处置
16.1 如何供应
DUPIXENT(dupilumab)注射液是一种透明至略微乳白色,无色至浅换色溶液,在单次-剂量预充填注射器有或无针头护帽中供应。每个预充填注射器有或无针头护帽被设计输送300 mg的DUPIXENT在2 mL溶液。
DUPIXENT是可得到在纸盒含或2个预充填注射器带针罩或2个预充填注射器。
16.2 贮存和处置
DUPIXENT是无菌和无防腐剂。遗弃任何未使用部分。
贮存在原始纸盒以避光保护。在冰箱在36°F至46°F(2°C至8°C)。必要时,预充填注射器可能保持在室温至77°F(25°C)共最大14天。不要贮存高于77°F(25°C)。从冰箱取出后,DUPIXENT必须在14天使用或遗弃。
不要暴露注射器至热或直接阳光。
任何未使用药品或废料应按照当地要求遗弃。
不要冻结。不要暴露于热。不要摇晃。
17 患者咨询资料
建议患者和/或护理人员阅读FDA-批准的患者说明书(患者资料和使用指导)患者开始使用DUPIXENT前和每次处方更新时因为可能有他们需要知道的新资料
给药指导
对患者和/或护理人员提供适当训练对适当皮下注射技术,包括无菌术,和使用前制备和DUPIXENT的给药。建议患者遵循尖锐物遗弃建议[见使用指导]。
超敏性
建议患者如他们经受任何全身超敏性反应症状,终止DUPIXENT和寻求立即医学关注[见警告和注意事项(5.1)]。
结膜炎和角膜炎
建议患者咨询他们的卫生保健提供者如发生新发作或恶化的眼症状[见警告和注意事项(5.2)]。
共存性哮喘
建议患者有共存性哮喘没有告诉他们的医生不要调整或停止他们的哮喘治疗[见警告和注意事项(5.3)]。

