批准日期:2017年8月1日;公司:Celgene Corporation
为治疗:急性髓性白血病
https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/209606s000lbl.pdf
适应证和用途
IDHIFA是一种异柠檬酸脱氢酶-2抑制剂适用为成年患者有复发或难治性急性髓性白血病(AML)的治疗当被FDA-批准的测试检测到有一个异柠檬酸脱氢酶-2(IDH2)突变。(1.1).
剂量和给药方法
100 mg口服每天1次直至疾病进展或不可接受毒性。(2.2).
剂型和规格
片:50 mg或100 mg(3).
禁忌证
无(4).
警告和注意事项
胚胎-胎儿毒性:IDHIFA可能致胎儿危害当给予一位妊娠妇女。忠告对胎儿潜在风险。(5.2,8.1,8.3).
不良反应
最常见不良反应(≥20%)包括恶心,呕吐,腹泻,升高的胆红素,和食欲减低(6.1).
报告怀疑不良反应,联系Celgene Corporation电话1-888-423-5436或FDA电话1-800-FDA-1088或www.fda.gov/medwatch.
在特殊人群中使用
哺乳:建议妇女不要哺乳喂养。(8.2).
完整处方资料
1 适应证和用途
1.1 急性髓性白血病
IDHIFA是适用为当被一种FDA-批准的测试检测到有一个异柠檬酸脱氢酶-2(IDH2)突变有复发或难治性急性髓性白血病(AML)成年患者的治疗。
2 剂量和给药方法
2.1 患者选择
为AML用IDHIF的治疗选择患者根据在血或骨髓中IDH2突变的存在[见适应证和用途(1.1)和临床研究(14.1)]。在http://www.fda.gov/CompanionDiagnostics. 可得为到在AML中IDH2突变的检测的FDA-批准的测试的资料
2.2 推荐剂量
IDHIFA的推荐开始剂量为100 mg口服每天1次有或无食物直至疾病进展或不可接受毒性。对无疾病进展或不可接受毒性患者,治疗共最小6个月允许对临床反应时间。
不要分裂或压碎IDHIFA片。给予IDHIFA片口服每天约相同时间。如一剂IDHIFA至正常时间表被呕吐,缺失,或不能在寻常时间服用,尽可能在相同天马上给予剂量,和返回下一天正常时间表。
2.3 对毒性监视和剂量修饰
IDHIFA的开始前评估血细胞计数和血液化学对白细胞增多和肿瘤溶解综合证 和监视在一个最小每2周共至少治疗期间至少头3个月。及时处理任何异常[见不良反应(6.1)]。
对毒性中断给药或减低剂量。对剂量修饰指导见表1。

3 剂型和规格
IDHIFA可得到以下片强度:
● 50-mg片:淡黄色至黄色椭圆形薄膜包衣片一侧凹陷”ENA“和另一侧上“50”。
● 100-mg片:谈黄色至黄色胶囊形膜包衣片一侧凹陷”ENA“和另一侧上“100”。
4 禁忌证
无。
5 警告和注意事项
5.1 分化综合症
在临床试验中,14%用IDHIFA治疗患者经受分化综合证,它可能是危及生命或致命性如不治疗。分化综合证是伴随骨髓细胞迅速增殖和分化。而对分化综合证没有诊断测试,用IDHIFA治疗患者中症状包括急性呼吸道窘迫群代表为呼吸困难和/或缺氧(68%)和需要补充氧(76%);肺浸润(73%)和肺积液(45%);肾受损(70%);发热(36%);淋巴结病变(33%);骨痛(27%);周围水肿有迅速体重增量(21%);和心包积液(18%)。肝,肾,和多器官功能不全也曽被观察到。分化综合证曽被观察到有和无同时的白细胞增多,和早为DHIFA开始后10天和在至5个月后。
如怀疑分化综合证,开始口服或静脉皮质激素(如,地塞米松[dexamethasone]10 mg每12小时)和血流动力学监视直至改善。仅在症状解决后滴定减低皮质激素。随过早终止皮质激素治疗可能复发分化综合证症状。如严重肺症状需要插管或呼吸机支持,和/或皮质激素的开始后肾功能不全持续共超过48小时,中断IDHIFA直至体征和症状是不再严重[见剂量和给药方法(2.3)]。推荐住院为密切观察和监视有肺和/或肾表现的患者。
5.2 胚胎-胎儿毒性
根据动物胚胎-胎儿毒性研究,IDHIFA可致胚胎-胎儿危害当给予至一位妊娠妇女。在动物胚胎-胎儿毒性研究,enasidenib致胚胎-胎儿毒性开始在0.1倍稳态临床暴露根据浓度时间曲线下面积(AUC)在推荐人剂量。忠告生殖潜能女性用IDHIFA治疗期间和末次剂量IDHIFA后共至少1个月使用有效避孕。忠告有生殖潜能女性伴侣男性使用有效避孕用IDHIFA治疗期间和末次剂量IDHIFA后共至少1个月使用有效避孕。妊娠妇女,患者成为妊娠当接受IDHIFA,或有妊娠女性伴侣男性应被忠告对胎儿潜在风险[见在特殊人群中使用(8.1,8.3)]。
6 不良反应
在说明书中任何处描述以下严重的不良反应:
● 分化综合证[见警告和注意事项(5.1)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
单剂量-药物IDHIFA的安全性评价是根据214例患者有复发或难治性AML患者被至接受100 mg每天[见临床研究(14.1)]。对IDHIFA暴露中位时间为4.3个月(范围0.3至23.6)。观察到用IDHIFA 30-天和60-天死亡率分别为4.2%(9/214)和11.7%(25/214)。
任何级别的最常见不良反应(≥20%)为恶心,呕吐,腹泻,升高的胆红素和食欲减低。
在77.1%的患者被报道的严重不良反应。最频数严重的不良反应(≥2%)为白细胞增多(10%),腹泻(6%),恶心(5%),呕吐(3%),食欲减低(3%),肿瘤溶解综合证(5%),和分化综合证(8%)。分化综合证事件特征为严重的包括发热,急性肾衰竭,缺氧,呼吸衰竭,和多器官衰竭。
总之,92/214患者(43%)需要一个剂量中断由于一个不良反应;最常见不良反应导致剂量中断为分化综合证(4%)和白细胞增多(3%)。10/214患者(5%)需要剂量减低由于一个不良反应;无不良反应需要剂量减低在多于2患者。36/214患者(17%)永久地终止IDHIFA由于一个不良反应;永久终止为白细胞增多(1%)。
表2中显示试验中报道的不良反应。

其他临床上显著不良反应发生在≤10的患者包括:
呼吸,胸,和纵隔疾患:肺水肿,急性呼吸道窘迫群综合证。
在表3中显示在在有复发或难治性AML患者观察到选定的基线后实验室数值中变化。
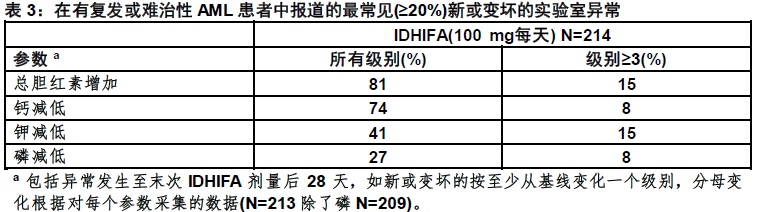
升高的胆红素
IDHIFA通过UGT1A1的抑制作用可能干扰胆红素代谢[见临床药理学(12.3)]。37%患者(80/214)胆红素升高≥2 x ULN至少一次。那些经历总胆红素升高 ≥2 x ULN患者中,35%有升高在治疗的头一个月内,和89%没有同时转氨酶的升高或其他不良事件与肝疾患相关。无患者需要为高胆红素血症剂量减低;治疗被中断在3.7%患者,共一个中位数6天。三例患者(1.4%) 永久终止IDHIFA由于高胆红素血症。
非感染性白细胞增多
IDHIFA可能诱导骨髓增殖导致一个白细胞计数迅速增加。
肿瘤溶解综合症
IDHIFA可能诱导骨髓增殖导致在肿瘤细胞中一个迅速减低它可能具有对肿瘤溶解综合症一个风险。
8 在特殊人群中使用
8.1 妊娠
风险总结
根据动物胚胎-胎儿毒性研究,IDHIFA可能致胎儿危害当给予至一位妊娠妇女。对IDHIFA在妊娠妇女使用没有可得到数据告知一个重大出生缺陷和流产的药物关联风险。在动物胚胎-胎儿毒性研究,enasidenib的口服给予至妊娠大鼠和兔器官形成期间被伴随胚胎-胎儿死亡率和改变对生长开始在0.1倍稳态临床暴露根据在推荐人剂量时AUC (见数据)。如该药在妊娠期间使用,或如患者当服用该药时成为妊娠,忠告患者对胎儿潜在风险。
在妊娠发生不良结局不管母亲的健康或药物的使用。不知道对适应证人群重大出生缺陷和流产的背景风险。在美国一般人群中,重大出生缺陷和在临床上认可妊娠中流产的估算背景风险分别为2%-4%和15%-20%。
数据
动物数据
器官形成期间(妊娠天6-17) 每天2次给予Enasidenib至妊娠大鼠在一个剂量30 mg/kg是伴随母体毒性和不良胚胎-胎儿包括植入后丢失,再吸收,减低活胎儿,较低胎儿出生体重,和骨骼变异。这些效应发生在大鼠在推荐人每天剂量100 mg/day时临床暴露约1.6倍。
在器官形成期间(妊娠天7-19)被治疗妊娠兔中,enasidenib是母体地毒性在剂量等于5 mg/kg/day或较高(暴露约0.1至0.6倍在推荐每天剂量稳态临床暴露)和致自发性流产在5 mg/kg/day(暴露约0.1倍在推荐每天剂量时稳态临床暴露)。
8.2 哺乳
风险总结
没有关于enasidenib或它的代谢物在人乳汁中的存在,对哺乳喂养婴儿影响,或对乳汁产品生产影响的数据。因为许多药物是排泄在人乳汁中和因为对在哺乳喂养婴儿不良反应潜能,用IDHIFA治疗期间和末次剂量后共至少1个月建议妇女不要哺乳喂养。
8.3 生殖潜能的女性和男性
妊娠测试
根据动物胚胎-胎儿毒性研究,当给予至一位妊娠妇女IDHIFA可能致胎儿危害[见在特殊人群中使用(8.1)]。
对生殖潜能的女性用IDHIFA治疗开始前得到一个妊娠测试。
避孕
女性
建议生殖潜能女性当接受IDHIFA避免成为妊娠。建议生殖潜能女性用IDHIFA治疗期间和末次剂量后共至少1个月使用有效避孕。IDHIFA的共同给药可能增加或减低组合激素避孕药的浓度。在此时不知道这个潜在药物相互作用的临床意义。
男性
建议有生殖潜能女性伴侣的男性用IDHIFA治疗期间和IDHIFA的末次剂量后共至少1个月使用有效避孕。
不孕不育
根据动物中发现,IDHIFA可能在生殖潜能女性和男性中损害生育力。不知道对生育力的这些效应是否是可逆的[见非临床毒理学(13.1)]。
8.4 儿童使用
尚未确定在儿童患者安全性和有效性。
8.5 老年人使用
在临床研究中无需对IDHIFA根据年龄剂量调整,214患者中61%为年龄65岁或以上,而24% 为老于75岁。未观察到患者年龄65岁或以上和较年轻患者间在有效性或安全性中总体差别。
11 一般描述
IDHIFA(enasidenib)是一种异柠檬酸脱氢酶-2(IDH2)酶的抑制剂。Enasidenib是可得到作为甲磺酸盐有化学名:2-methyl-1-[(4-[6-(trifluoromethyl)pyridin-2-yl]-6-{[2-(trifluoromethyl)pyridin-4-yl]amino}1,3,5-triazin-2-yl)amino]propan-2-ol methanesulfonate.
或2-Propanol,2-methyl-1-[[4-[6-(trifluoromethyl)-2-pyridinyl]-6-[[2-(trifluoromethyl)-4pyridinyl]amino-1,3,5-triazin-2-yl]amino]-,methanesulfonate(1:1)。化学结构为:
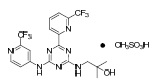
经验式为C19H17F6N7O • CH3SO3H(C20H21F6N7O4S),和分子量为569.48 g/mol。Enasidenib 是实际上不溶于水性溶液(溶解度 ≤74 µg/mL)跨越生理学pH范围(pH 1.2和7.4)。
IDHIFA(enasidenib)可得到为一个50-mg片(等同于60 mg enasidenib甲磺酸盐)和一个100-mg片(等同于120 mg enasidenib甲磺酸盐)为口服给药。每片含无活性成分胶体二氧化硅,羟丙基纤维素,醋酸琥珀羟丙甲纤维素,氧化铁黄,硬脂酸镁,微晶纤维素,聚乙二醇,聚乙烯醇,硫酸月桂酸钠,羧甲淀粉钠,滑石,和二氧化钛。
12 临床药理学
12.1 作用机制
Enasidenib是一种异柠檬酸脱氢酶2(IDH2)酶的小分子抑制剂。Enasidenib靶向突变体IDH2 变异体R140Q,R172S,和R172K在体外比野生型酶在浓度较低约40-倍。突变体IDH2酶被enasidenib的抑制作用导致减低2-羟戊二酸[2-hydroxyglutarate(2-HG)]水平和诱导骨髓分化在体外和在体内在IDH2突变AML的小鼠移植物模型,在来自患者有突变的IDH2AML血样品中,enasidenib减低2-HG水平,减低母细胞计数[blast counts]和增加成熟骨髓细胞百分率。
12.2 药效动力学
心脏电生理学
在一项开放研究在患者有一个IDH2突变有晚期血液学恶性病评价用enasidenib对QTc延长潜能。对一个单次剂量30 mg至650 mg和多次剂量100 mg每天在空腹状态根据QTc数据,用enasidenib治疗后未观察到巨大均数变化在QTc间期(>20 ms)。
12.3 药代动力学
一个单次剂量100 mg后血浆峰浓度(Cmax) 为1.3 µg/mL[%变异系数(CV%) 56.4],和13 µg/mL(CV% 46.3)在稳态对100 mg每天。Enasidenib的浓度时间曲线下面积(AUC)增加在一个大约剂量正比例方式从50 mg(0.5倍被批准的推荐剂量)至450 mg(4.5倍被批准的推荐剂量)每天给药。稳态血浆水平被达到在29天内每天1次给药。积蓄是约10-倍当每天1次给药。
吸收
100 mg口服剂量的enasidenib后绝对生物利用度为约57%。一个口服单剂量后至Cmax(Tmax)中位时间为4小时。
分布
Enasidenib的均数分布容积(Vd)为55.8 L(CV% 29)。在体外Enasidenib的人血浆蛋白结合为98.5%和它的代谢物AGI-16903为96.6%。
Enasidenib不是对P-糖蛋白或BCRP的一个底物,而AGI-16903为P糖蛋白和BCRP两者的底物。Enasidenib和AGI-16903不是MRP2,OAT1,OAT3,OATP1B1,OATP1B3,和OCT2的底物.
消除
Enasidenib有一个末端半衰期137小时(CV% 41)和一个均数总机体清除率(CL/F)0.74 L/hour(CV% 71)。
代谢
Enasidenib占在循环和AGI-16903放射性为89%,N-去烷基代谢物,代表10%的循环放射性。
在体外研究提示enasidenib的代谢是通过多个CYP酶介导(如,CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6,和CYP3A4),个通过多个UGTs(如,UGT1A1,UGT1A3,UGT1A4,UGT1A9,UGT2B7,和UGT2B15)。代谢物AGI-16903的进一步代谢也是通过多个酶介导(如,CYP1A2,CYP2C19,CYP3A4,UGT1A1,UGT1A3,和UGT1A9)。
排泄
89%的enasidenib在粪中被消除和11%在尿中。未变化enasidenib的排泄占在粪中放射标记药物34%和在尿中0.4%。
特殊人群
对以下协变量:年龄(19岁至100岁),种族(白种人,黑种人,或亚裔),轻度肝受损[定义为总胆红素≤ 正常上限(ULN)和天门冬转氨酶(AST) >ULN或总tot胆红素1至1.5倍ULN和任何AST],肾受损(定义为肌酐清除率≥30 mL/min按Cockcroft-Gault公式),性别,体重(39 kg至136 kg),和体表面积未观察到对enasidenib的药代动力学临床意义的影响。
药物相互作用研究
在体外研究提示enasidenib抑制CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6,CYP3A4,和UGT1A1的活性。Enasidenib抑制P-gp,BCRP,OAT1,OATP1B1,OATP1B3,和OCT2,但不抑制MRP2或OAT3。Enasidenib诱导CYP2B6和CYP3A4。
在体外研究提示代谢物AGI-16903抑制CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,和CYP2D6的活性。AGI-16903抑制BCRP,OAT1,OAT3,OATP1B1,和OCT2,但不抑制P-gp,MRP2,或OATP1B3。IDHIFA的共同给药可能增加或减低组合的激素避孕药的浓度。在此时不知道这个潜在的药物相互作用的临床上意义。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未曽用enasidenib进行致癌性研究。
Enasidenib不是致突变性在一个在体外细菌回复突变(Ames)试验。Enasidenib不是至畸变性在一项在体外人淋巴细胞染色体畸变试验,或在一项体内大鼠骨髓微核试验。
尚未用enasidenib在动物中进行生育力研究。在重复给药毒性研究用每天两次口服给予enasidenib在大鼠直至90-天时间,在雄性和雌性生殖器官被报道的变化包括曲细精管腿型性变性,精子减低,精囊和前列腺的萎缩,黄体减小和卵巢中无力滤泡增加,和子宫中萎缩。
14 临床研究
14.1 急性髓性白血病
在一项开放,单臂,多中心,两-队列临床试验(研究AG221-C-001,NCT01915498)的199例成年患者有复发或难治性AML和一个IDH2突变,患者被赋予接受100 mg每天给药被评价Idhifa的疗效。队列1包括101患者和队列2包括98患者。 IDH2突变被当地一个诊断测试和被Abbott RealTime™ IDH2分析回顾地确证,或被Abbott RealTime™ IDH2分析预期地鉴定,它是FDA-批准的测试为选择有AML患者为用IDHIFA治疗。IDHIFA是被口服地给予在开始给药予100 mg每天直至疾病进展或不可接受毒性。允许减低剂量处理不良事件。
在表4中显示基线人口统计和疾病特征。在两个研究队列基线人口统计和疾病特征为相似。
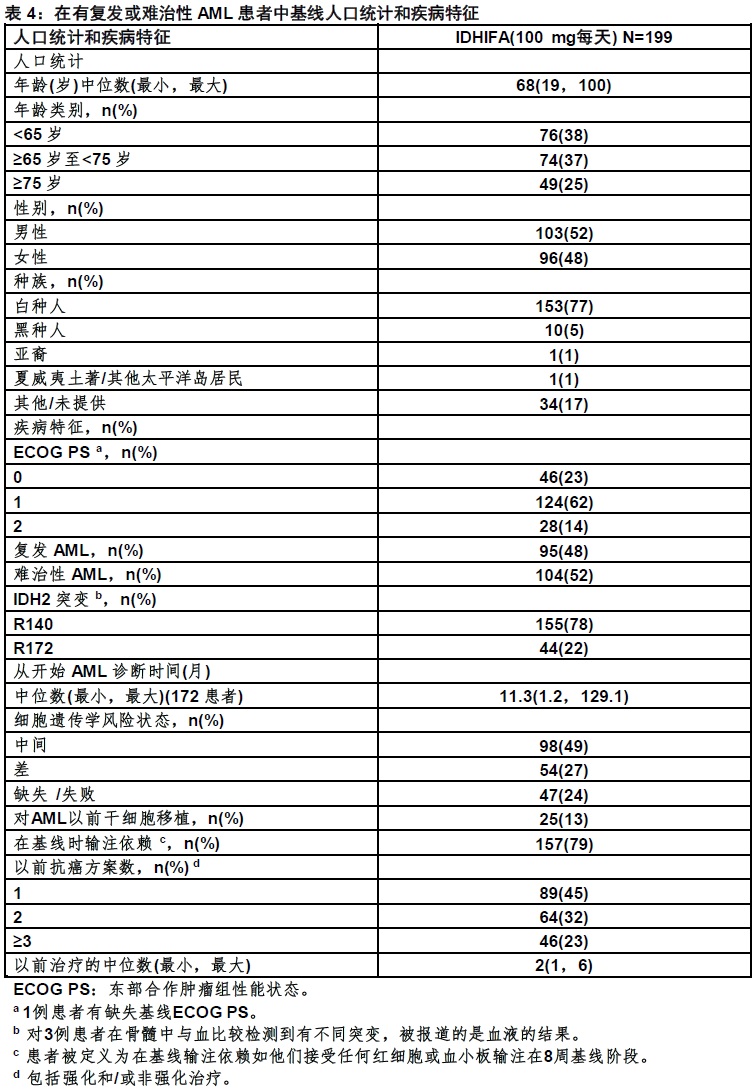
在完全缓解(CR)/完全缓解率有部分血液学恢复(CRh),CR/CRh的时间,和从输注依赖性至输注独立无关的转换率的基础上确定疗效。表5显示疗效结果和两队列是相似。中位随访为6.6月(范围,0.4至27.7月)。观察到有或R140或R172突变患者中相似的CR/CRh率。
对实现一个CR/CRh患者,至首次反应中位时间为1.9月(范围,0.5至7.5月)和至CR/CRh最佳反应中位时间为3.7月(范围,0.6至11.2月)。46例患者实现CR/CRh的最佳反应中,39(85%) 在开始IDHIFA的6月内实现。.
在157例患者是在基线时依赖于红细胞(RBC) 和/或血小板输注中,53(34%)任何56-天基线后阶段期间成为不依赖RBC和血小板输注。在42例患者在基线时不依赖于RBC和血小板两者的输注,在基线后任何56-天基线后阶段期间32(76%)仍保持不依赖于输注。
16 如何供应/贮存和处置
16.1 如何供应
50-mg片:淡黄色至黄色椭圆形薄膜包衣片一侧凹陷”ENA“和在其他侧“50”。
●30-片50-mg片与一个干燥剂罐瓶(NDC 59572-705-30)
●30-片100-mg片与干燥剂罐瓶(NDC 59572-710-30)
100-mg片:淡黄色至黄色胶囊形膜包衣一侧凹陷”ENA“和在其他侧“100”。
16.2 贮存
贮存在20°C-25°C(68°F-77°F);外出允许在15°C-30°C间(59°F-86°F)[见USP控制室温]。瓶紧密闭保存。贮存在原始瓶(与一个干燥剂罐)避潮湿保护。
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(用药指南)。
分化综合证
忠告患者对发生发展分化综合证的风险早在10天和用治疗头5月期间。要求患者立即报告分化综合证的提示性任何症状,例如发热,咳嗽或呼吸困难,骨痛,体重迅速增量或他们的臂或腿肿胀,向他们的卫生提供者为进一步评价[见黑框警告和警告和注意事项(5.1)]。
肿瘤溶解综合症
忠告患者对发生肿瘤溶解综合症的风险。忠告患者对维持高液体摄入的重要性,和需要频繁监视血化学值[见剂量和给药方法(2.3)和不良反应(6.1)]。
胃肠道不良反应
忠告患者对经受胃肠道反应风险例如腹泻,恶心,呕吐,食欲减低,和他们的味觉变化。要求患者报告这些事件至他们的卫生保健提供者,和建议患者如何处理它们[见不良反应(6.1)]。
升高的血胆红素
告知患者用IDHFA可能致升高的血胆红素,它是由于它的作用机制,而不是由于肝损伤。建议患者报告他们的皮肤颜色任何变化或他们的眼睛的白色至他们的卫生保健提供者为进一步评价[见不良反应(6.1)].
胚胎-胎儿毒性和避孕药的使用
建议有生殖潜能女性患者当接受IDHIFA使用有效避孕方法和避免妊娠当用治疗和治疗的完成后共1个月。建议IDHIFA 治疗期间在事件中患者立即告知他们的卫生保健提供者一个妊娠或如怀疑妊娠。建议有生殖潜能女性伴侣男性用IDHIFA治疗期间和末次剂量IDHIFA后共至少1个月使用有效避孕。IDHIFA的共同给药可能增加或减低组合激素避孕药的浓度。在此时不知道这个潜在药物相互作用的临床意义[见警告和注意事项(5.2)和在特殊人群中使用(8.3)]。
哺乳
用IDHIFA治疗期间和最后剂量后共至少1月建议妇女不要哺乳喂养 [见在特殊人群中使用(8.2)].
给药和贮存指导
● 建议患者不要咀嚼或分裂片但与一杯水吞咽整片。
● 指导患者如他们缺失一剂或一剂IDHIFA后呕吐,尽可能在相同天马上服用和下一天返回正常时间表。警告患者不要服2 剂组成缺失剂量[见剂量和给药方法(2.2)]。
● 保持IDHIFA在原始容器。保持与干燥剂罐紧闭与内部片避潮湿保护[见如何供应/贮存和处置(16.2)]。

