Ibrance(palbociclib)使用说明书2015年第一版
批准日期:2015年2月3日;公司:Pfizer Inc。
加速批准,突破性治疗指定和优先审评
FDA 药品评价和研究中心血液学和肿瘤产品室主任说:“palbociclib添加至来曲唑对被诊断有转移乳癌妇女提供一种新颖治疗选择,”“FDA承诺通过我们的加快批准监管加快癌症药物的上市批准。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/207103s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用IBRANCE所需所有资料。请参阅IBRANCE完整处方资料。
IBRANCE®(palbociclib)胶囊,为口服使用
美国初次批准:2015
适应证和用途
IBRANCE是一个激酶抑制剂适用与来曲唑联用为有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女的治疗作为初始基于内分泌治疗对其转移疾病。这个适应证是根据无进展生存(PFS)在加速批准下被批准。剂型批准此适应证可能取决于在验证性试验中临床获益的证明和描述。(1)
剂量和给药方法
IBRANCE胶囊是与食物与来曲唑联用口服。(2)
⑴推荐开始剂量:125 mg每天一次与食物服用共21天接着7天不治疗。(2.1)
⑵建议根据个体安全性和耐受性中断和/或剂量减低给药。(2.2)
剂型和规格
胶囊:125 mg,100 mg,和75 mg(3)
禁忌证
无(4)
警告和注意事项
⑴血液学:可能发生中性粒细胞减少。监视完全血细胞计数IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时。(5.1)
⑵感染:监视体征和症状和适当时不给药。(5.2)
⑶胚胎胎儿毒性:可能致胎儿危害。忠告患者对胎儿潜在风险和使用有效避孕。(5.4,8.1,8.3)
不良反应
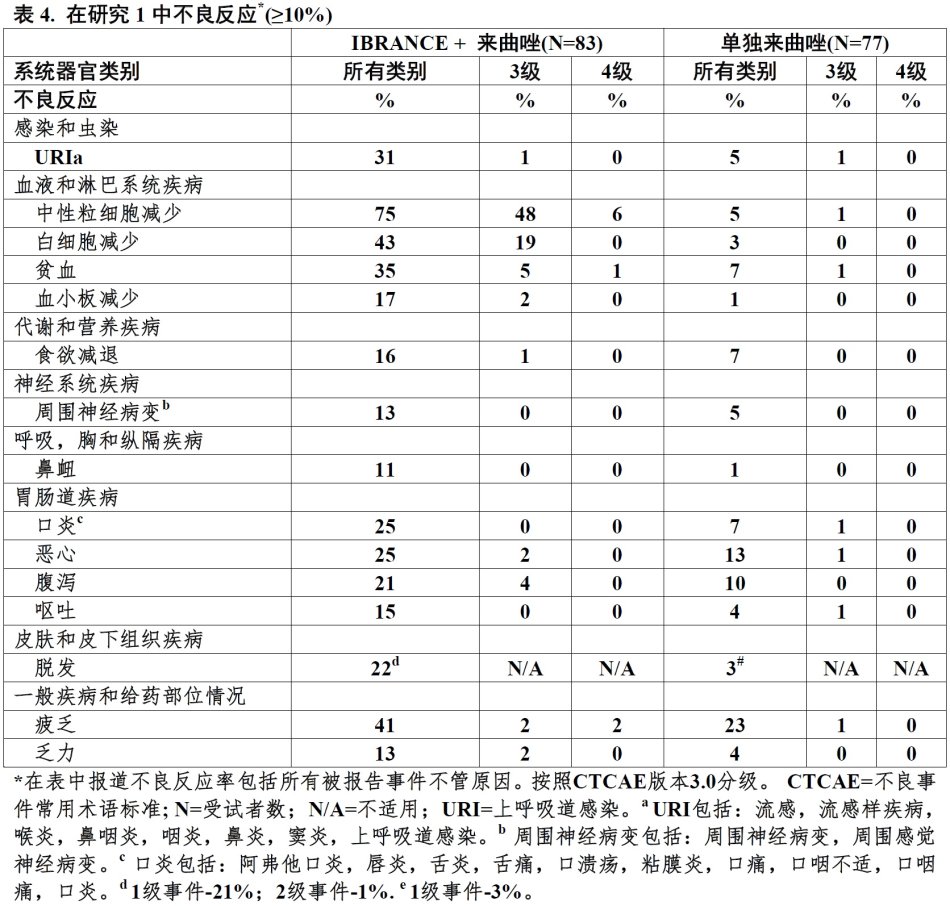
最常见不良反应(发生率 ≥10%)是中性粒细胞减少,白细胞减少,疲乏,贫血,上呼吸道感染,恶心,口炎,脱发,腹泻,血小板减少,食欲减退,呕吐,乏力,周围神经病变,和鼻衄。(6)
报告怀疑不良反应,联系Pfizer公司电话1-800-438-1985或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
CYP3A抑制剂:避免IBRANCE与强CYP3A抑制剂的同时使用。如强抑制剂不能避免,减低IBRANC剂量。(2.2,7.1)
CYP3A诱导剂:避免IBRANCE与强和中度CYP3A诱导剂的同时使用。(7.2)
CYP3A底物:有狭窄治疗指数敏感CYP3A4底物当与IBRANCE同时给予时剂量可能需要减低。(7.3)
完整处方资料
1 适应证和用途
IBRANCE是适用与来曲唑联用对有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女作为初始基于内分泌治疗对其转移疾病的治疗。
这个适应证是根据无进展生存(PFS)在加速批准下被批准的[见临床研究(14)]。对此适应证的继续批准可能取决于在验证性试验中临床获益的证明和描述。
2 剂量和给药方法
2.1 一般给药信息
IBRANCE的推荐剂量是一粒125 mg胶囊口服服用每天一次共21连续天接着不用治疗7天组成一个28天完整疗程。IBRANCE应与食物服用[见临床药理学(12.3)]与来曲唑2.5 mg每天一次联用连续28-天疗程自始至终给予。应鼓励患者在每天接近相同时间服用他们的剂量。
如患者呕吐或丢失一剂,在那天不应服用另外剂量。在寻常的时间服用下一次处方剂量。IBRANCE胶囊应被整吞(在吞咽前不要咀嚼,压碎或打开胶囊)。如破碎,压碎或不完整时不应摄入胶囊。
2.2 剂量调整
建议根据个体安全性和耐受性调整IBRANCE剂量[见警告和注意事项(5)]。
某些不良反应的处理[见警告和注意事项(5)]可能需要暂时中断剂量/延迟和/或减低剂量,或永久终止如同表1,2和3提供每种剂量减低计划[见警告和注意事项(5),不良反应(6)和临床研究(14)]。
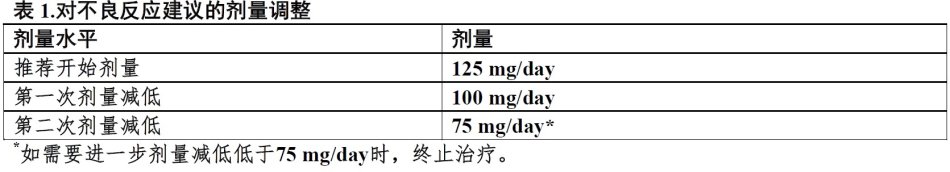
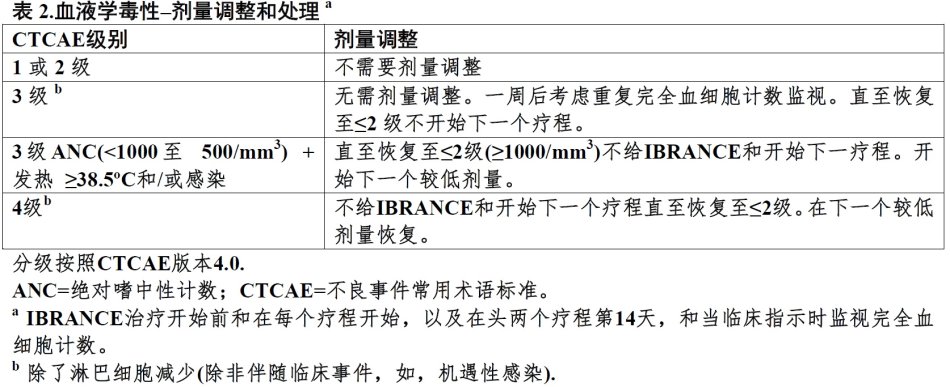

见制造商处方资料对共同给药产品,来曲唑,在毒性事件中剂量调整指导原则和其他相关安全性资料或禁忌证。
为与强CYP3A抑制剂使用剂量调整
避免强CYP3A抑制剂的同时使用和考虑没有或小CYP3A抑制作用另外同时药物。如患者必须用强CYP3A抑制剂共同给药,减低IBRANC剂量至75 mg每天一次。如强抑制剂被终止,增加IBRANCE剂量(抑制剂的3–5个半衰期后)至强CYP3A抑制剂使用前剂量[见药物相互作用(7.1)和临床药理学(12.3)]。
3 剂型和规格
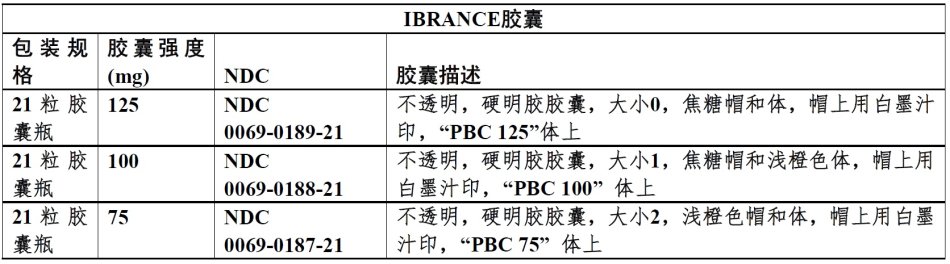
125 mg胶囊:不透明硬明胶胶囊,大小0,有焦糖帽和体,帽上用白墨汁印,体上“PBC 125”。
100 mg胶囊:不透明硬明胶胶囊,大小1,有焦糖帽和浅橙色体,帽上用白墨汁印,体上“PBC 100”。
75 mg胶囊:不透明硬明胶胶囊,大小2,有浅橙色帽和体,帽上用白墨汁印,体上“PBC 75”。
4 禁忌证
无
5 警告和注意事项
5.1 中性粒细胞减少
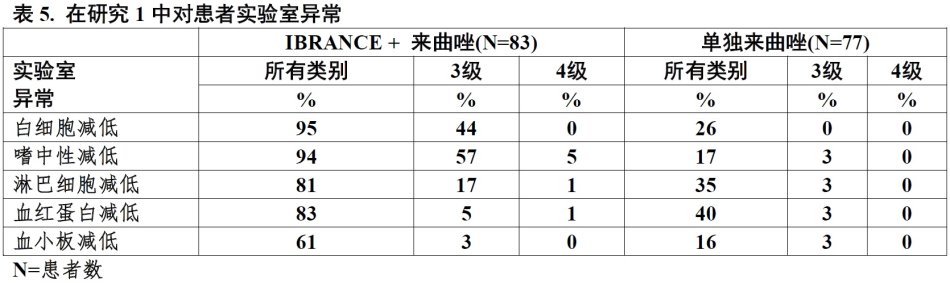
在临床试验用IBRANCE中曾观察到嗜中性计数减低。在随机临床试验接受IBRANCE加来曲唑患者报道嗜中性计数3(57%)或4级(5%)减低(研究1)。任何级别中性粒细胞减少每实验室数据的首次发作中位时间为15天(13-117天)。≥3级中性粒细胞减少中位时间为7天[见不良反应(6.1)]。
在IBRANCE临床计划中曾报道发热性中性粒细胞减少事件,虽然在研究1中未观察到发热性中性粒细胞减少病例。IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时监视完全血细胞计数。建议对发生3或4级中性粒细胞减少患者剂量中断,剂量减低或延迟治疗疗程开始[见剂量和给药方法(2.2)]。
5.2 感染
在研究1中用IBRANCE加来曲唑治疗患者与单独来曲唑治疗患者比较曾报道感染较高率。用IBRANCE加来曲唑治疗患者3或4级感染发生5%而单独用来曲唑治疗患者没有经受3或4级感染。监视患者感染的体征和症状和当医疗适当时治疗。
5.3 肺栓塞
在研究1中用IBRANCE加来曲唑治疗患者(5%)曾报道肺栓塞较高率,与之比较单独用来曲唑治疗患者无病例。监视患者肺栓塞体征和症状和当医疗适当时治疗。
5.4 胚胎胎儿毒性
根据动物中发现和作用机制,IBRANCE可能致胎儿危害。在大鼠和兔中在母体暴露根据曲线下面积(AUC)人临床暴露大于或等于4倍时IBRANCE致胚胎胎儿毒性。忠告有生殖潜能女性在用IBRANCE治疗期间和末次剂量后至少2周使用有效避孕[见在特殊人群中使用(8.1,8.3)和临床药理学(12.1)]。
6 不良反应
在说明书其他处描述以下标题:
●中性粒细胞减少[见警告和注意事项(5.1)]
●感染[见警告和注意事项(5.2)]
●肺栓塞[见警告和注意事项(5.3)]
6.1 临床研究经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在研究1中评价IBRANCE(125 mg/day)加来曲唑(2.5 mg/day)相比单独来曲唑的安全性。下面描述数据反映在研究1中在83/160例有ER-阳性,HER2-阴性晚期乳癌接受至少1剂治疗患者对IBRANCE暴露。对palbociclib治疗中位时间为13.8个月而对单独来曲唑臂来曲唑治疗中位时间 为7.6个月。
在研究1中接受IBRANCE加来曲唑患者由于某种任何级别不良反应剂量减低发生36%。对来曲唑不允许剂量减低。
接受IBRANCE加来曲唑患者由于一种不良反应永久终止发生7/83(8%)和单独接受来曲唑患者为2/77(3%)。接受IBRANCE加来曲唑患者中导致终止不良反应包括中性粒细胞减少(6%),乏力(1%),和疲乏(1%)。
在IBRANCE加来曲唑臂患者中被报道最常见任何级别不良反应(≥10%)是中性粒细胞减少,白细胞减少,疲乏,贫血,上呼吸道感染,恶心,口炎,脱发,腹泻,血小板减少,食欲减退,呕吐,乏力,周围神经病变,和鼻衄。
接受IBRANCE加来曲唑患者被最频报道严重不良反应是肺栓塞(3/83; 4%)和腹泻(2/83; 2%)。
在palbociclib加来曲唑臂(55%)与单独来曲唑臂(34%)比较观察到感染事件发生率增加。在IBRANCE临床计划中曾报道发热性中性粒细胞减少事件,虽然在研究1中未观察到病例。通过剂量减低和/或剂量延迟或暂时终止处理≥3级中性粒细胞减少由于中性粒细胞减少与永久终止率6%一致[见剂量和给药方法(2.2)]。
表4中列举在研究1中接受IBRANCE加来曲唑或单独来曲唑患者报道的不良药物反应(≥10%)。
7 药物相互作用
Palbociclib是主要地被CYP3A和磺基转移酶(SULT)酶SULT2A1代谢。在体内,palbociclib是一种CYP3A时间-依赖性抑制剂。
7.1 可能增加Palbociclib血浆浓度药物
CYP3A抑制剂的影响
在健康受试者中某种强CYP3A抑制剂(伊曲康唑[itraconazole])的共同给药增加palbociclib的血浆暴露87%。避免强CYP3A抑制剂的同时使用(如,克拉霉素[clarithromycin],茚地那韦[indinavir],伊曲康唑,酮康唑[ketoconazole],洛匹那韦[lopinavir]/利托那韦[ritonavir],奈法唑酮[nefazodone],奈非那韦[nelfinavir],泊沙康唑[posaconazole],利托那韦,沙奎那韦[saquinavir],特拉匹韦[telaprevir],泰利霉素[telithromycin],维拉帕米[verapamil],和伏立康唑[voriconazole])。IBRANCE治疗期间避免柚子或柚子汁。如IBRANCE与某种强CYP3A抑制剂的共同给药不能避免,减低IBRANCE剂量[见剂量和给药方法(2.2)和临床药理学(12.3)]。
7.2 可能减低Palbociclib血浆浓度药物
CYP3A诱导剂的影响
在健康受试者中一种强CYP3A诱导剂的共同给药(利福平[rifampin])减低palbociclib的血浆暴露85%。避免强CYP3A诱导剂(如,苯妥英[phenytoin],利福平,卡马西平[carbamazepine]和圣约翰草的同时使用)[见临床药理学(12.3)]。
中度CYP3A诱导剂的共同给药也可能减低IBRANCE的血浆暴露。避免中度CYP3A诱导剂的同时使用(如,波生坦[bosentan],依非韦伦[efavirenz],依曲韦林[etravirine],莫达非尼[modafinil],和奈夫西林[nafcillin])[见临床药理学(12.3)]。
7.3 可能被Palbociclib改变其血浆浓度的药物
在健康受试者中,与单独给予咪达唑仑比较,咪达唑仑与多次剂量IBRANCE的共同给药增加咪达唑仑血浆暴露61%。敏感CYP3A治疗指数狭窄的剂量(如,alfentanil,环孢素[cyclosporine],二氢麦角胺,麦角胺[ergotamine],依维莫司[everolimus],芬太尼[fentanyl],匹莫齐特[pimozide],奎尼丁[quinidine],西罗莫司[sirolimus]和他克莫司[tacrolimus])可能需要减低因IBRANCE可能增加其暴露[见临床药理学(12.3)]。
8 在特殊人群中使用
8.1 妊娠
风险总结
根据动物中发现和作用机制,IBRANCE当给予妊娠妇女可能致胎儿危害[见临床药理学(12.1)]。在动物研究中,在母体暴露根据AUC在推荐人剂量时人临床暴露是 ≥4 倍时palbociclib致畸胎性和胎儿毒性。没有可得到的药物-关联风险信息人数据。忠告妊娠妇女对胎儿潜在风险。不知道对指示人群重大出生缺陷和流产的背景风险。但是,在美国一般人群背景风险重大出生缺陷为2-4%和临床上识别妊娠的流产是15-20%。
数据
动物数据
在雌性大鼠一项生育力和早期胚胎发育研究,在交配前至妊娠第7天口服给予palbociclib共15天,没有致胚胎毒性在剂量至300 mg/kg/day有母鼠全身暴露在推荐剂量时人暴露(AUC)约4 倍时。
在大鼠和兔中胚胎胎儿发育研究,妊娠动物在器官形成期时分别接受口服剂量至300 mg/kg/day和20 mg/kg/day palbociclib。在大鼠中母畜毒性剂量300 mg/kg/day是胎儿毒性,导致胎鼠体重减轻。在大鼠中在剂量 ≥100 mg/kg/day,有骨骼变异发生率增加(在第七颈椎处存在肋骨发生率增加)。在兔中在母畜毒性剂量20 mg/kg/day,有骨骼变异的发生率增加,包括前肢小指骨。在大鼠中300 mg/kg/day和在兔中20 mg/kg/day时,母畜全身暴露是人在推荐剂量时暴露(AUC)约4和9倍。
曾报道CDK4/6双敲除小鼠由于严重贫血死于胎儿发育晚期(妊娠第14.5天直至出生)。但是,敲除小鼠数据可能不能预测人中效应由于靶点抑制作用程度的差异。
8.2 哺乳
风险总结
在人乳汁中palbociclib的存在,IBRANCE对哺乳儿童的影响,或IBRANCE对乳汁生成的影响没有数据。因为许多药物排泄在人乳汁中和因为哺乳婴儿来自IBRANCE严重不良反应潜能,忠告哺乳妇女用IBRANCE治疗期间终止哺乳喂养。
8.3 有生殖潜能女性和男性
避孕
女性
忠告有生殖潜能女性在用IBRANCE治疗期间和末次给药后至少两周使用有效避孕。忠告 女性如她们成为妊娠,或如用IBRANCE治疗期间怀疑妊娠,联系其卫生保健提供者[见在特殊人群中使用(8.1)]。
不孕不育
男性
根据动物中发现,用IBRANCE治疗男性生育力可能被累及[见癌发生,突变发生,生育力受损(13.1)]。
8.4 儿童使用
未曾研究IBRANCE在儿童患者中安全性和疗效。
8.5 老年人使用
在研究1中84例接受IBRANCE患者中,37例患者(44%)为≥65岁和8例患者(10%)为 ≥75岁。这些患者和较年轻患者间未观察到IBRANCE安全性或有效性总体差别但不能除外有些老年个体敏感性较高。
8.6 肝受损
根据一项群体药代动力学分析包括183例患者,其中40例患者有轻度肝受损(总胆红素 ≤ ULN和AST > ULN,或总胆红素 >1.0至1.5 × ULN和任何AST),轻度肝受损对palbociclib的暴露没有影响。尚未研究有中度或严重肝受损(总胆红素 >1.5 × ULN和任何AST)患者中palbociclib的药代动力学[见临床药理学(12.3)]。
8.7 肾受损
根据一项群体药代动力学分析包括183例患者,其中73例患者有轻度肾受损(60 mL/min ≤ CrCl <90 mL/min)和29例患者有中度肾受损(30 mL/min ≤ CrCl <60 mL/min),轻度和中度肾受损对 对palbociclib的暴露没有影响。尚未在有严重肾受损患者中研究palbociclib的药代动力学[见临床药理学(12.3)]。
10 药物过量
对IBRANCE没有已知的抗毒物。IBRANCE过量的治疗应由一般支持措施组成。
11 一般描述
为口服给药IBRANCE胶囊含125 mg,100 mg,或75 mg的palbociclib,一种激酶抑制剂。Palbociclib的分子式是C24H29N7O2。分子量为447.54道尔顿。化学名为6-acetyl-8-cyclopentyl-5-methyl-2-{[5-(piperazin-1-yl)pyridin-2yl]amino}pyrido[2,3-d]pyrimidin-7(8H)-one,和其结构式为:
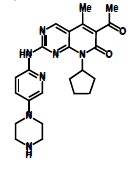
Palbociclib是一种黄色至橙色粉有pKa为7.4(第二哌嗪氮)和3.9(吡啶氮)。在或低于pH 4,palbociclib行为如同高溶解度化合物。高于pH 4,药物物质溶解度显著减低。
无活性成分:微晶纤维素,一水乳糖,羟基乙酸淀粉钠,胶体二氧化硅,硬脂酸镁,和硬明胶胶囊壳。浅橙色,浅橙色/焦糖和焦糖不透明胶囊壳含明胶,红色氧化钛,黄色氧化铁,和二氧化钛;和印刷油墨含虫胶,二氧化钛,氢氧化铵,丙二醇和二甲基硅油。
12 临床药理学
12.1 作用机制
Palbociclib是一种周期蛋白-依赖激酶(CDK)4和6的抑制剂。周期蛋白D1和CDK4/6是导致细胞增殖信号通路的下游。在体外,palbociclib雌激素受体(ER)-阳性乳癌细胞株通过阻断细胞从细胞周期G1进入S期的进展减低细胞增殖。用palbociclib和抗雌激素的联合处理与单独各个药物处理比较,乳癌细胞株导致视网膜母细胞瘤蛋白(Rb)磷酸化的减低导致减低E2F表达和信号和阻止增加生长。在体外用palbociclib和抗雌激素联合处理ER-阳性乳癌细胞株导致增加细胞衰老,在药物去除后持续至6天。体内研究用一种患者-衍生的ER-阳性乳癌 异种移植动物模型显示palbociclib和来曲唑组合与各个药物单独比较,增加Rb磷酸化,下游信号和肿瘤生长的抑制作用。
12.2 药效动力学
心脏电生理学
在184例有晚期癌患者中评价palbociclib对QTc间期的影响。在治疗时间表(如,125 mg每天共21连续天后接着7天不用药组成的28天完全疗程)后观察到均数最大稳态palbociclib浓度被检测的QTc 间期中无巨大变化(即,>20 ms)。
12.3 药代动力学
有实体肿瘤患者包括晚期乳癌和在健康受试者中确定palbociclib药代动力学特征。
吸收
在口服给药后一般地在6至12小时间观察到Palbociclib的均数Cmax(达峰浓度,Tmax)。口服125 mg剂量后IBRANCE的均数绝对生物利用度为46%。在给药范围25 mg至225 mg,AUC和Cmax 一般随剂量正比例增加。重复每天一次给药后8天内实现稳态。用重复每天一次给药,palbociclib被积蓄有中位积蓄比值2.4(范围1.5-4.2)。
食物影响:空腹条件下人群Palbociclib吸收和暴露非常低约13%。在这个人群小亚组中食物摄入增加palbociclib暴露,但不改变对其余人群palbociclib暴露至临床相关程度。因此,食物摄入减低palbociclib暴露的受试者间变异性,支持IBRANCE与食物的给予。当在IBRANCE给药前1小时和后2小时给予高脂肪,高热量食物时(约800至1000卡路里有150,250,和500至600卡路里分别来自蛋白,碳水化物和脂肪),与IBRANCE在过夜空腹条件给予比较,palbociclib的人群平均AUCinf和Cmax分别增加21%和38%,12%和27%,当给予低脂肪,低热量食物(约400至500卡有120,250,和28至35 卡分别来自蛋白,碳水化合物和脂肪),和分别13%和24%,当中度脂肪,标准热量食物(约500 to 700卡有75至105,250至350和175至245卡分别来自蛋白,碳水化合物和脂肪)。
分布
在体外palbociclib与人血浆蛋白的结合是约85%,跨越浓度范围500 ng/mL至5000 ng/mL无浓度依赖性。几何均数表观分布容积(Vz/F)为2583 L(26% CV)。
代谢
在体外和在体内研究表明palbociclib在人中进行肝代谢。人口服单次给予125 mg剂量[14C]palbociclib后,对palbociclib主要代谢途径涉及氧化和而磺化,与乙酰化和葡萄糖醛酸化贡献作为次要途径。Palbociclib是在血浆中主要循环-衍生实体(23%)。主要循环代谢物是palbociclib的葡萄糖醛酸结合物,虽然在排泄物中它仅代表1.5%的给与剂量。Palbociclib被广泛地代谢,未变化药物分别占粪和尿中放射性的2.3%和6.9%。在粪中,palbociclib氨基磺酸结合物是主要药物相关化合物,占给药剂量的26%。在体外研究用人肝细胞,肝胞液和S9分量,和重组SULT酶表明在palbociclib代谢中主要涉及CYP3A和SULT2A1。
消除
有晚期乳癌患者中Palbociclib表观口服清除率几何均数(CL/F)是63.1 L/hr(29%CV),和血浆消除半衰期均数(±标准差)是29(±5)小时。在6例健康男性受试者给予单次口服剂量[14C]palbociclib,在15天被回收中位总给予放射性剂量的91.6%;粪(剂量74.1%)为主要排泄途径,与尿中回收17.5%剂量。被排泄多数物料是代谢物。
年龄,性别,和体重
根据在183例癌症患者一项群体药代动力学分析(50例男性和133例女性患者,年龄范围从22至89岁,和体重范围从37.9至123 kg),性别对palbociclib的暴露没有影响,和年龄和体重对palbociclib的暴露无临床上重要影响。
儿童人群
未曾在<18岁患者中评价IBRANCE的药代动力学。
药物相互作用
在体外数据表明CYP3A和SULT酶SULT2A1是主要涉及palbociclib代谢。在人中每天125 mg给药至至稳态后Palbociclib是一个弱CYP3A时间依赖性抑制剂。在体外,在临床上相关浓度palbociclib不是CYP1A2,2A6,2B6,2C8,2C9,2C19,和2D6的抑制剂,和不是CYP1A2,2B6,2C8,和3A4的诱导剂。
CYP3A抑制剂:来自在健康受试者中(N=12)一项药物相互作用试验数据表明多次200 mg每天剂量伊曲康唑与单次125 mg IBRANCE剂量的共同给药,相对于单独给予单次125 mg IBRANCE剂量。分别增加palbociclib AUCinf和the Cmax约87%和34%。
CYP3A诱导剂:来自在健康受试者中(N=14)一项药物相互作用试验数据表明多次600 mg每天剂量的利福平与单次125 mg IBRANCE剂量的共同给药,相对于单独给予单次125 mg IBRANCE剂量,减低palbociclib的AUCinf和Cmax分别为85%和70%。
CYP3A底物:Palbociclib是一种CYP3A弱时间依赖性的抑制剂,在健康受试者中(N=26)一项药物相互作用试验中,在人中每天125 mg给药至稳态后,咪达唑仑与多次剂量IBRANCE的共同给药,当与单独给予咪达唑仑比较时,咪达唑仑的AUCinf和Cmax值分别增加61%和37%。
胃pH升高药物:在一项健康受试者药物相互作用试验中,的共同给药单次125 mg剂量的IBRANCE与在进食条件下多剂量质子泵抑制剂(PPI)雷贝拉唑[rabeprazole],当与单独给予单剂量IBRANCE比较,减低palbociclib Cmax 41%,但对AUCinf(13%减低)影响有限。给予H2-受体拮抗剂和局部抗酸药与PPIs比较对胃pH的影响减低,在进食条件下这些类型酸-减低药物对palbociclib暴露的影响预计是小。在进食条件下,PPIs,H2-受体拮抗剂,或局部抗酸药对palbociclib暴露没有临床上相关影响。在另一个健康受试者研究,在空腹条件下单剂量IBRANCE与多剂量PPI雷贝拉唑的共同给药当与给予单剂量IBRANCE比较,减低palbociclib AUCinf和Cmax分别为62%和80%。
来曲唑:来自一项有乳癌患者药物相互作用试验数据显示当两药共同给药palbociclib和来曲唑间无药物相互作用。
Palbociclib对转运蛋白的影响:在体外评价表明在临床上相关浓度时有低潜能抑制药物转运蛋白P-糖蛋白(P-gp),乳癌耐药蛋白(BCRP),有机阴离子转运蛋白(OAT)1,OAT3,有机阳离子转运蛋白(OCT)2和有机阴离子转运多肽(OATP)1B1,OATP1B3的活性。
转运蛋白对Palbociclib的影响:根据在体外数据,在治疗剂量时P-gp和BCRP介导转运很可能不影响palbociclib口服的吸收程度。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未曾用palbociclib进行致癌性研究。
在体外中国仓鼠卵巢细胞中微核试验和在体内雄性大鼠接受剂量≥100 mg/kg/day共三周骨髓Palbociclib是致染色体断裂。通过非整倍体[aneugenic]机制发生染色体断裂。在体外细菌回复突变(Ames)试验Palbociclib没有致突变性和在体外人淋巴细胞染色体畸变试验中不诱发结构性染色体畸变。
在一项雌性大鼠生育力研究中,在任何剂量至300 mg/kg/day(根据AUC人临床暴露约4倍)和在大鼠重复剂量毒性研究中直至300 mg/kg/day和犬中3 mg/kg/day(在推荐剂量对人暴露(AUC)和相似分别约6倍) palbociclib不影响交配或生育力,在雌性生殖组织中未观察到不良效应。未用palbociclib进行雄性生育力研究;但是,在重复剂量毒性研究,在大鼠和犬在分别30和0.2 mg/kg/day(在推荐剂量,人暴露(AUC)分别约11和0.1倍)观察到睾丸退行性变性,在大鼠和犬一个12-周非•给药阶段后是部分地可逆。
13.2 动物毒理学和/或药理学
在大鼠中在27-周重复剂量毒理学研究鉴定出伴随胰腺中变化(胰岛细胞空泡形成)葡萄糖代谢改变(糖尿,高血糖,胰岛素减低),眼(白内障,晶体退行性变性),牙(在活跃生长牙中牙釉细胞退行性变性/坏死),肾(小管空泡形成,慢性进展性肾病变),和脂肪组织(萎缩)和在雄性在剂量≥30 mg/kg/day最常见(在推荐剂量时人暴露(AUC)约11倍)。在大鼠15-周重复-剂量毒理学研究存在有些这些发现(糖尿/高血糖,胰岛细胞空泡形成,和肾小管空泡形成),但发生率和严重程度较低。在这些研究所用大鼠在研究开始时约7周龄。 在犬重复剂量至39周时间毒理学研究没有鉴定到改变的葡萄糖代谢或在胰腺,眼,牙,肾,和脂肪组织中伴随变化。
14 临床研究
研究1是在有ER-阳性,HER2-阴性晚期乳癌,对其晚期疾病未曾接受过既往全身治疗绝经后妇女进行的一项随机化,开放,多中心IBRANCE加来曲唑相比单独来曲唑的研究。在研究1中总共165例患者被随机化。是按疾病部位分层随机化(内战脏相比骨只相比其他)和通过无疾病-间期(从辅助治疗结束至疾病复发>12个月相比从辅助治疗结束至疾病复发或晚期疾病从头开始≤12个月)。口服给予IBRANCE剂量125 mg每天连续共21天接着7天不治疗。患者接受研究治疗直至进展性疾病,不可处理的毒性,或撤去知情同意。
纳入这项研究患者有中位年龄63岁(范围38至89)。患者多数是高加索人(90%)和所有患者有美国东部肿瘤协作组(ECOG)性能状态(PS)0或1。在其晚期乳癌诊断前新辅助或辅助情况下43%患者曾接受化疗和33%曾接受抗激素治疗。在新辅助或辅助情况中49%患者无既往全身治疗。患者的多数(98%)有转移疾病。19%患者只有骨疾病和48%患者有内脏疾病。
研究的主要疗效结局测量是研究者按照实体瘤版本1.0(RECIST)中反应评价标准-评估PFS。表6和图1中总结来自研究1主要疗效结果。跨越患者亚组的无病生存间期,级别部位和既往治疗观察到一致性结果。联用对PFS的治疗影响也被放射影像回顾性独立审评与观察到危害比(HR)0.621(95% CI:0.378,1.019)支持。被研究者评估的有可测量疾病患者中总体反应率,IBRANCE加来曲唑与单独来曲唑臂比较联用较高(55.4%相比39.4%)。PFS最终分析时,事件有37%总体生存(OS)数据不成熟。
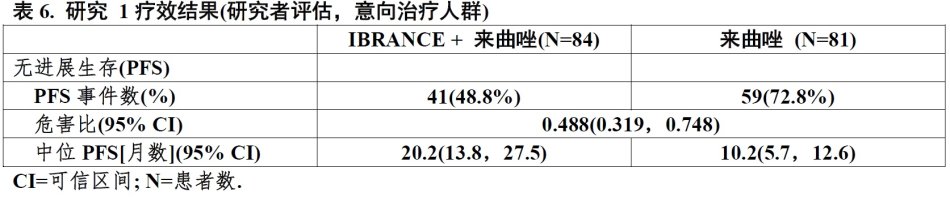
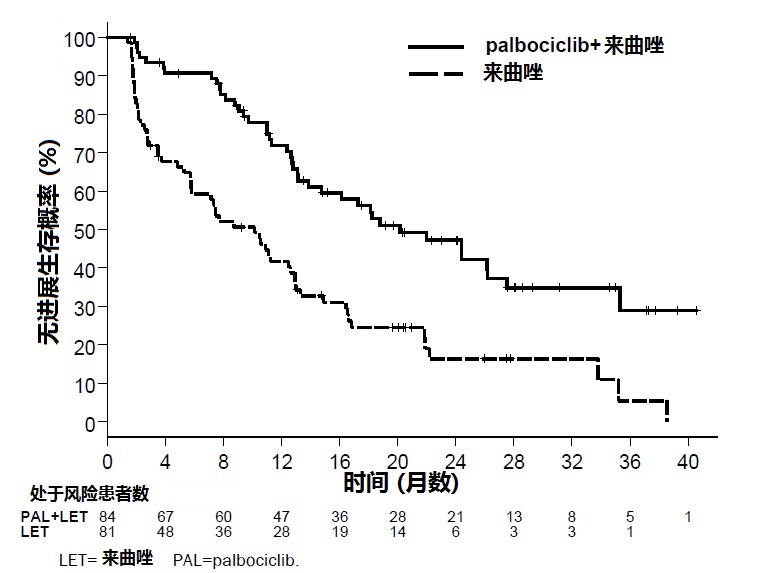
图1. 研究 1 –无进展生存Kaplan-Meier曲线(研究者评估,意向治疗人群)
16 如何供应/贮存和处置
IBRANCE以以下强度和包装规格供应;
贮存在20 ºC至25 ºC(68 ºF至77 ºF);外出允许15 ºC至30 ºC间(59 ºF至86 ºF)。
17 患者咨询资料
见FDA-被批准患者说明书(患者资料)。
●忠告患者立即报告骨髓抑制或感染,例如发热,发冷,眩晕,气短,虚弱或对出血和/或挫伤趋向任何增加的任何体征或症状[见警告和注意事项(5.2)]。
●忠告患者立即报告肺栓塞任何体征或症状,例如气短,胸痛,呼吸急促,和心动过速[见警告和注意事项(5.3)]。
●忠告患者有食物服用IBRANCE和整吞IBRANCE胶囊。
●IBRANCE可能与柚子相互作用。当用IBRANCE治疗时患者不应消耗柚子汁产品。
●告知患者避免强CYP3A抑制剂和强CYP3A诱导剂。
●忠告患者告知其卫生保健提供者所有同时药物,包括处方药,非处方药,维生素,和草药产品[见药物相互作用(7)]。
●如患者呕吐或丢失一剂,在那天不应服用另一剂量。应在寻常时间服用下一次处方剂量。 应整吞IBRANCE胶囊(吞咽前不咀嚼,压碎或打开胶囊)。如胶囊被破坏,压碎,或不完整不应摄入胶囊。
●忠告生殖潜能女性IBRANCE治疗期间和末次剂量后共至少两周使用有效避孕。忠告女性如用IBRANCE治疗期间她们成为妊娠或如被怀疑妊娠联系她们的卫生保健提供者[见警告和注意事项(5.4)和在特殊人群中使用(8.1和8.3)]。

