JAKAFI™(ruxolitinib)片使用说明书2011年第一版
批准日期:2011年11月16日; Jakafi由Wilmington, Del.Incyte Corp.公司制造。
译自被批准的使用说明书:http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/202192lbl.pdf
美 国FDA药物评价和研究中心血液和肿瘤产品办公室主任Richard Pazdur,M.D.说:“Jakafi代表在肿瘤中详尽了解疾病特异性机制,允许药物靶向特异性分子通路的另一个实例”“临床试验导致这个批注集中在经常遇到的骨髓纤维化,包括脾脏肿大和疼痛患者的问题。”
Jakafi是在FDA的优先审评程序下被审评,即对可能提供显著进展超过可得到治疗的治疗或对当前没有适当治疗提供治疗加快6-个月审评药物的一种程序。
本治疗正在按处方药物用户费用法[Prescription Drug User FeeAct]下的目标日期2011年12月3日前被批准和已被指定为孤儿药物,确定疾病在美国影响人数少于200,000人。
处方资料重点
这些重点不包括安全和有效使用JAKAFI所需所有资料。
请参阅下文为JAKAFI.的完整处方资料
JAKAFI™ (ruxolitinib)片
美国初始批准:2011
适应证和用途
Jakafi是一种激酶抑制剂适用于治疗中间或高危骨髓纤维化,包括原发性骨髓纤维化,真性红细胞增多症后骨髓纤维化和原发性血小板增多症后骨髓纤维化患者。 (1)
剂量和给药方法
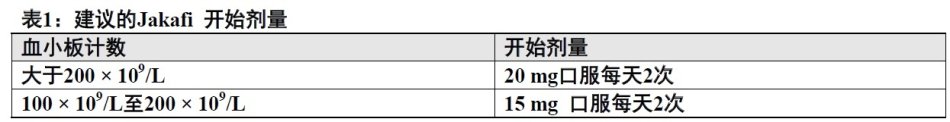
(1)对血小板计数大于200/μL患者,Jakafi的开始剂量是20mg口服每天2次给药,而对血小板计数100/μL和200/μL间患者15 mg每天2次。 (2.1)
(2)起始用Jakafi治疗前进行完全血细胞计数。监视完全血细胞计数s每2至4周直至剂量稳定化,,和然后当临床指示。对血小板计数减低调整剂量。(2.1) (2.2)
(3)根据反应增加剂量和因推荐至最大每天2次25 mg。如脾脏无减小或症状无改善6个月后终止。(2.3)
剂型和规格
片:5 mg,10 mg,15 mg,20 mg和25 mg。(3)
禁忌证
无。(4)
警告和注意事项
(1)可能发生血小板计数减低,贫血和中性粒细胞减少。用减低剂量,或中断或输血处理。(5.1)
(2)评估患者感染的体征和症状和及时开始适当治疗。开始用Jakafi治疗前严重感染应已解决。(5.2)
不良反应
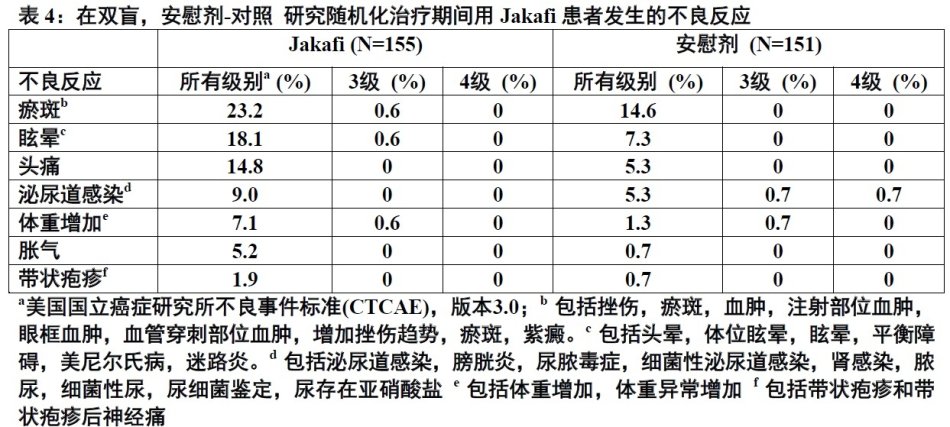
最常见血液学不良反应(发生率 > 20%)是血小板计数减低和贫血。最常见非血液学不良反应(发生率>10%) 是瘀斑, 眩晕和头痛。(6.1)
为报告怀疑不良反应,联系Incyte公司电话1-855-463-3463或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
药物相互作用
(1)强CYP3A4抑制剂:对血小板计数大于或等于100/μL患者减低Jakafi开始剂量至10mg每天2次和同时强CYP3A4抑制剂。血小板计数小于100/μL患者中避免使用。(2.4) (7.1)
特殊人群中使用
(1)肾受损:对中度(CrCl 30-59 mL/min)或严重肾受损(CrCl 15-29mL/min)和血小板计数间100/μL和150 X 109/L患者Jakafi开始剂量减低至10 mg每天2次。终末肾病(CrCl小于15 mL/min)不需要透析患者中和有中度或严重肾受损和血小板计数小于100/μL患者避免使用。(2.5)(8.6)
(2)肝受损:对任何程度肝受损和血小板计数100/μL和150/μL间患者Jakafi开始剂量减低至10mg每天2次。肝受损与血小板计数小于100/μL患者避免使用。(2.5) (8.7)
(3)哺乳母亲: 终止哺乳或终止药物考虑药物对母亲的重要性。(8.3)
完整处方资料
1. 适应证和用途
Jakafi适用于治疗中间或高危骨髓纤维化,包括原发性骨髓纤维化,真性红细胞增多症后骨髓纤维化和原发性血小板增多症后骨髓纤维化患者。
2. 剂量和给药方法
2.1 推荐的开始剂量
Jakafi的推荐开始剂量是根据血小板计数(表1)。在开始治疗前必须进行一个完全血细胞计数(CBC)和血小板计数,每2至4周直至剂量稳定化,和然后当临床指示时[见警告和注意事项(5.1)]。可根据安全性和疗效滴定调整剂量。
2.2 治疗中断对血小板计数减低调整剂量指南
对血小板计数小于50 ×109/L中断治疗。血小板计数恢复在这个水平上后,可能再开始给药或血小板计数恢复至可接受水平后增加。表2示范以前中断后再开始Jakafi可能使用最大允许剂量。

减低剂量
血小板计数减低如表3概述应考虑减低剂量目标避免为血小板计数减低中断剂量。
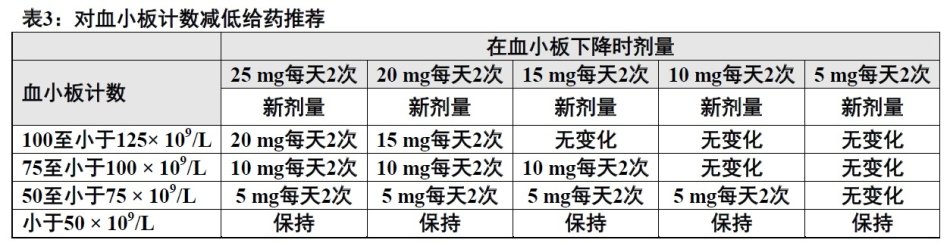
2.3根据反应调整剂量
如考虑疗效不充分和血小板和嗜中性计数适当,剂量可增加以5 mg每天2次增量至最大25 mg每天2次。在治疗的头四。
根据有限的临床资料,长期维持5 mg每天2次剂量未显示反应和继续使用这个剂量应限制在获益超过潜在风险的患者。
符合以下条件的患者考虑增加剂量:
(1)未能达到从治疗前基线减低,或可触摸到脾脏长度的50%或用CT或MRI测量脾体积减低35%;
(2)在4周时血小板计数大于125 /μL和血小板计数永未低于100 /μL;
(3)ANC水平大于0.75 /μL。
2.4 与同时强CYP3A4抑制剂时的剂量调整
在健康志愿者中药代动力学研究的基础上,当Jakafi与强CYP3A4抑制剂给药时(例如但不限于boceprevir,克拉霉素[clarithromycin],考尼伐坦[conivaptan],葡萄柚汁[grapefruitjuice],印地那韦[indinavir],伊曲康唑[itraconazole],酮康唑[ketoconazole],洛匹那韦/利托那韦[lopinavir/ritonavir],咪拉地尔[mibefradil],奈法唑酮[nefazodone],那非那韦[nelfinavir],泊沙康唑[posaconazole],利托那韦[ritonavir],沙奎那韦[saquinavir],特拉匹韦[telaprevir],泰利霉素[telithromycin],伏立康唑[voriconazole]),对血小板计数大于或等于100/μL患者推荐的开始剂量是10 mg每天2次。应做另外剂量调整与小心监视安全性和疗效。
血小板计数小于100 /μL患者中应避免Jakafi与强CYP3A4抑制剂的同时给药[见药物相互作用(7.1)]。
2.5 器官受损
肾受损
在有肾受损志愿者中药代动力学研究基础上,对血小板计数100/μL和150/μL间和中度(CrCl 30-59mL/min)或严重肾受损(CrCl 15-29 mL/min)患者推荐的开始剂量是10mg每天2次。应用仔细监视安全性和疗效做另外剂量调整。
对用透析有终末肾病患者对有血小板计数100/μL和200/μL间患者推荐的开始剂量是15 mg或对有血小板计数大于200/μL患者20mg。随后剂量应在每次透析阶段后透析天给予。应用仔细监视安全性和疗效做另外剂量调整。
在不需要透析终末肾病患者中(CrCl 小于15mL/min)和in有中度或严重肾受损有血小板计数小于100/μL患者应避免使用Jakafi[见特殊人群中使用(8.6)]。
肝受损
在有肝受损志愿者中药代动力学研究的基础上,对有血小板计数100/μL和150/μL间患者推荐的开始剂量是10mg每天2次。应用仔细监视安全性和疗效做另外剂量调整。
有肝受损和有血小板计数小于100/μL患者中应避免使用Jakafi [见特殊人群中使用(8.7)]。
2.6 给药方法
Jakafi是口服给药和可与食物或无食物给药。
如丢失一次给药,患者不应服用另一剂量,但应服用下一次处方剂量。
当除血小板计数减低外理由终止Jakafi治疗,可考虑逐步减小Jakafi剂量,例如每周5 mg每天2次。
对不能摄入片患者,可通过鼻胃管给Jakafi (8 French或更大) 如下:
悬浮一片在约40 mL水中搅拌 约10分钟。
在片已分散后6小时内,用适当注射器通过鼻胃管给药。
应用约75 mL水冲洗管。尚未评价通过鼻胃管给予配制物对Jakafi暴露的影响。
3.剂型和规格
5 mg片 – 圆和白色在一侧有“INCY”和另侧“5”。
10 mg片 - 圆和白色在一侧有“INCY”和另侧“10”。
15 mg片 – 椭圆和白色在一侧有“INCY”和另侧“15”。
20 mg片 – 胶囊形和白色在一侧有“INCY”和另侧“20”。
25 mg片 – 椭圆和白色在一侧有“INCY”和另侧“25”。
4. 禁忌证
无。
5. 警告和注意事项
5.1 血小板计数减低,贫血和中性粒细胞减少
用Jakafi治疗可引起血液学不良反应,包括血小板计数减低,贫血和中性粒细胞减少。起始用Jakafi治疗前必须进行一个完全血细胞计数[见剂量和给药方法(2.1)]。
在开始治疗时患者有血小板计数小于200 × 109/L治疗期间更可能发生血小板计数减低。
血小板计数减低一般是可逆的和通常是通过减低剂量或暂时不用Jakafi处理。如临床指示,可给予输注血小板[见剂量和给药方法(2.2),和不良反应(6.1)]。
患者发生贫血可能需要输血。对发生贫血患者也可能考虑调整Jakafi剂量。
中性粒细胞减少(ANC小于0.5 × 109/L)一般是可逆的和用暂时不给Jakafi处理[见不良反应 (6.1)]。
当临床指示和需要调整给药时应监视完全血细胞计数[见剂量和给药方法(2.2),和不良反应 (6.1)]。
5.2 感染
应评估患者发生严重细菌性,结核分枝杆菌,真菌和病毒感染风险。开始用Jakafi治疗前应解决活动性严重感染。医生应咨询观察接受Jakafi患者感染的体征和症状和及时开始适当治疗。
带状疱疹
医生应告知患者关于带状疱疹早期体征和症状和劝告患者尽可能早寻求治疗[见不良反应 (6.1)]。
6. 不良反应
6.1 临床试验经验
因为临床试验是在广泛不同条件下进行,某药临床试验观察到的不良反应率不能与另一药物临床试验中的发生率直接比较而且可能不反映实践中观察到的发生率。
在6项临床研究617例患者,包括两项3期研究301例骨髓纤维化患者评估Jakafi的安全性中位随访10.9个月。
这2项3期研究中,患者中位暴露至Jakafi时间9.5个月(范围0.5至17个月),有88.7%患者治疗长于6个月和24.6%治疗长于12个月。111例患者开始治疗为15mg每天2次和190例患者开始20 mg每天2次。
在一项Jakafi的双盲,随机化,安慰剂-对照研究,155例患者用Jakafi治疗。最频繁不良药物反应为血小板计数减低和贫血[见表5]。血小板计数减低,贫血和中性粒细胞减少是剂量相关效应。三个最频繁非血液学不良反应是瘀斑,眩晕和头痛[见表4]。
用Jakafi治疗患者观察到11.0%为不良事件终止,不管原因和用安慰剂治疗患者为10.6%。
中断或终止Jakafi后,骨髓纤维化症状一般恢复至治疗前水平历时约1周。有孤立病例在急性并发疾病期间患者终止Jakafi,其后患者临床病程继续恶化;然而,在这些患者中尚未确定终止治疗是否影响临床过程。当除了血小板计数减低原因终止治疗时,可能考虑逐渐减小Jakafi剂量[见剂量和给药方法(2.6)]。
表4展示在双盲,安慰剂-对照研究随机化治疗期间在接受Jakafi患者中发生的最常见不良反应。
选择不良药物反应的描述
贫血
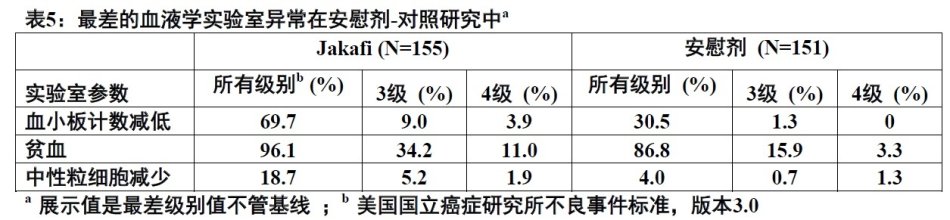
在2项3期临床研究中,首次CTCAE2级或以上贫血开始中位时间约6周。1例患者(0.3%)因贫血终止治疗。接受Jakafi患者中,治疗后8至12周血红蛋白中位减低达最低值低于基线约1.5至2.0 g/dL和然后逐渐恢复至新的稳态低于基线约1.0g/dL。在治疗期间观察到患者这种模式不管治疗期间是否接受输血。
在随机化,安慰剂-对照研究中,随机化治疗期间60%用Jakafi治疗患者和38%接受安慰剂患者接受红细胞输血。输血患者中,用Jakafi治疗患者每月输血中位数为1.2而安慰剂治疗患者为1.7。
血小板计数减低
在2项3期临床研究中,开始发生3或4级血小板计数减低患者中位时间约8周。随减低剂量或剂量中断血小板计数减低一般可逆。血小板计数恢复至50×109/L以上中位时间为14天。接受Jakafi患者4.7%给予输注血小板而接受对照方案患者为4.0%。因血小板计数减低而终止治疗,接受Jakafi患者为0.7%而接受对照方案患者为0.9%。开始Jakafi前,患者有血小板计数100 × 109/L至200 ×109/L与有血小板计数大于200 × 109/L患者比较,有较高频数3或4级血小板计数减低(16.5%相比7.2%)。
中性粒细胞减少
在2项3期临床研究中,有1.0%患者因为中性粒细胞减少而减低或停止Jakafi。
表5提供在安慰剂-对照研究中,接受Jakafi或安慰剂治疗患者报道的临床血液学异常的频数和严重程度。
来自安慰剂-对照研究的另外资料
用Jakafi治疗患者25.2%和用安慰剂治疗患者7.3%新发生谷丙转氨酶(ALT)或1级异常变坏。Jakafi组大于或等于2级升高的发生率为1.9%,3级为1.3%而无4级ALT升高。
用Jakafi治疗患者17.4%和用安慰剂治疗患者6.0%发生新发生的谷草转氨酶(AST)异常或1级异常变坏。Jakafi组2级AST升高的发生率为0.6%,无3或4级AST升高。
用Jakafi治疗患者16.8%和用安慰剂治疗患者0.7%发生新发生的胆固醇异常或1级升高变坏。对Jakafi,2级胆固醇升高的发生率为0.6%,与无3或4级 胆固醇升高。
7. 药物相互作用
抑制或诱导细胞色素P450酶药物
Ruxolitinib主要被CYP3A4代谢。
强CYP3A4抑制剂:在健康受试者中,与Jakafi 给药(10 mg单剂量)后酮康唑200mg每天2次共4天与单独接受Jakafi比较,ruxolitinib的Cmax和AUC分别增加33%和91%。同时与酮康唑半衰期也从3.7延长至6.0小时。药效动力学标志物,pSTAT3抑制作用,的变化与酮康唑同时给药后相应的ruxolitinib AUC一致。
当Jakafi与强CYP3A4抑制剂给药时建议减低剂量[见剂量和给药方法(2.4)]。应严密监视患者和根据安全性和疗效滴定调整剂量。
轻度或中度CYP3A4抑制剂:在健康受试者中,给予Jakafi (10 mg单剂量)后红霉素[erythromycin],一种中度CYP3A4抑制剂,在500mg每天2次共4天时,与单独接受Jakafi比较,ruxolitinib的Cmax和AUC分别增加8%和27%。药效动力学标志物,pSTAT3抑制作用的变化与相应暴露资料一致。
当Jakafi与轻度或中度CYP3A4抑制剂共同给药时(如,红霉素)建议无需调整剂量。
CYP3A4诱导剂:在健康受试者中,给予Jakafi(50 mg单剂量)后利福平[rifampin]600mg每天1次共10天,与单独接受Jakafi比较,ruxolitinib的Cmax和AUC分别减低32%和61%。此外,对ruxolitinib的活性代谢物的相对暴露增加约100%。这个增加部分地解释报道的药效动力学标志物pSTAT3抑制作用不成比例地10%减低。
当Jakafi与CYP3A4诱导剂共同给药时建议无需剂量调整。应密切监视患者和根据安全性和疗效滴定调整剂量。
8. 特殊人群中使用
8.1 妊娠
妊娠类别C
在妊娠妇女中没有Jakafi的适当和well-对照良好研究。在胚胎胎儿毒性研究中,用在母体毒性剂量ruxolitinib处理导致晚期再吸收和胎畜体重减轻。在妊娠期间只有如潜在获益超过对胎儿潜在风险时才应使用Jakafi。
在器官形成期口服给予Ruxolitinib至妊娠大鼠或兔,大鼠剂量15,30或60 mg/kg/day和兔中10,30或60mg/kg/day。无致畸胎性证据。然而,注意到在大鼠中在最高和母畜毒性剂量60mg/kg/day时,胎畜体重减低约9%。这个剂量导致暴露(AUC)约为人最大推荐剂量25mg每天2次时的2倍。在兔中,注意到在最高和母畜毒性剂量60mg/kg/day,胎畜体重较低约8%和增加晚期再吸收。这个剂量为人最大推荐的剂量临床暴露的约7% 。
在大鼠围产期(新生畜前和后)发育研究中,妊娠动物被给予ruxolitinib在剂量直至30mg/kg/day来自植入通过哺乳。对在最高评价剂量(在人最大推荐剂量25mg每天2次临床暴露的34%),在幼崽中生育能力指数或对母体或胚胎胎畜生存,生长和发育参数无药物相关不良发现。
8.3 哺乳母亲
不知道ruxolitinib是否排泄在人乳汁中。Ruxolitinib和/或其代谢物排泄在哺乳大鼠乳汁,浓度是母体血浆的13-倍。因为许多药物排泄在人乳和因为哺乳婴儿来自Jakafi严重不良反应的潜能,应做出决策终止哺乳或终止药物,考虑药物对母亲的重要性。
8.4 儿童使用
尚未确定Jakafi在儿童患者中安全性和有效性。
8.5 老年人使用
在临床研究中骨髓纤维化患者用Jakafi总数中,51.9%是年龄65岁和以上。这些患者和较年轻患者间未观察到Jakafi的安全性或有效性的总体差别。
8.6 肾受损
一项研究在健康受试者[CrCl 72-164 mL/min (N=8)]和在有轻度[CrCl 53-83 mL/min(N=8)],中度[CrCl 38-57 mL/min(N=8)],或严重肾受损[CrCl 15-51mL/min(N=8)]受试者中评价单剂量Jakafi (25mg)的安全性和药代动力学。还附加纳入8例有终末肾病需要血液透析的受试者。
有不同程度肾受损和有正常肾功能受试者中ruxolitinib的药代动力学相似。然而,ruxolitinib代谢物血浆AUC值随肾受损严重程度增加而增高。这在有终末肾病需要血液透析的受试者最明显。药效动力学标志物,pSTAT3抑制作用,的变化与相应代谢物暴露增加一致。Ruxolitinib不被透析去除,然而,不能除外某些活性代谢物被透析的去除。
当Jakafi给予有中度(CrCl 30-59 mL/min)或严重肾受损(CrCl 15-29 mL/min)与有血小板计数100× 109/L和150 × 109/L间患者和在透析的终末期肾病患者建议减低剂量[见剂量和给药方法(2.5)]。
8.7 肝受损
在一项研究健康受试者(N=8)和有轻度[Child-Pugh A(N=8)],中度[Child-PughB(N=8)],或严重肝受损[Child-Pugh C(N=8)]受试者中评价单剂量Jakafi(25mg)的安全性和药代动力学。轻,中和严重肝受损患者与正常肝功能患者比较ruxolitinib的平均AUC分别增加87%,28%和65%。肝受损患者与健康对照比较末端消除半衰期延长(4.1-5.0小时相比2.8小时)。药效动力学标志物,pSTAT3抑制作用,的变化与相应ruxolitinib暴露增高一致,除了严重(Child-PughC)肝受损队列其中有些受试者药效动力学活性比根据ruxolitinib血浆浓度预期更延长。
当任何程度肝受损患者给予Jakafi和有血小板计数间100 × 109/L和150 ×109/L,建议减低剂量[见剂量和给药方法(2.5)]。
10. 药物过量
对用Jakafi过量无已知抗毒药。曾给予单剂量直至200mg有可接受的急性耐受性。较高于推荐的重复剂量伴随骨髓抑制增加包括白细胞减少,贫血和血小板计数减低。应给予适当支持治疗。
血液透析预期不增强ruxolitinib的消除。
11.一般描述
Ruxolitinib磷酸盐是一种激酶抑制剂化学名为(R)-3-(4-(7H-pyrrolo[2,3d]pyrimidin-4-yl)-1H-pyrazol-1-yl)-3-cyclopentylpropanenitrilephosphate和分子量404.36。Ruxolitinib磷酸盐有下列结构式:
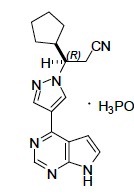
Ruxolitinib磷酸盐是一种白色至米白至浅粉色粉和跨越pH范围1至8溶于水性缓冲液。
Jakafi(ruxolitinib)片为口服给药。每片含ruxolitinib磷酸盐等于5 mg,10 mg,15 mg,20mg和25mg的ruxolitinib游离碱与微晶纤维素,乳糖一水合物,硬脂酸镁,胶体二氧化硅,钠淀粉乙醇酸,聚乙烯吡啶酮和羟丙基纤维素在一起。
12. 临床药理学
12.1 作用机制
Ruxolitinib,一种激酶抑制剂,抑制Janus相关激酶(JAKs)JAK1和JAK2,介导对造血和免疫功能重要的若干细胞因子和生长因子信号。JAK信号涉及细胞因子受体对STATs(信号转导物和转炉激活的补充,激活和随后STATs定位至细胞核导致基因表达的调控。
骨髓纤维化(MF)是一种骨髓增生性肿瘤(MPN)已知与JAK1和JAK2信号失调有关联。在一个的JAK2V617F-阳性MPN小鼠模型中,口服给予ruxolitinib预防脾肿大,脾中JAK2V617F突变细胞优先减少和减低循环炎症细胞因子(如,TNF-α,IL-6)。
12.2 药效动力学
在来自健康受试者和MF患者全血中Ruxolitinib抑制细胞因子诱导STAT3磷酸化。在健康受试者和骨髓纤维化患者Jakafi给药在给药后2小时导致STAT3磷酸化的最大抑制,10小时恢复接近基线。
12.3 药代动力学
吸收
在临床研究中,口服给予Jakafi后ruxolitinib被迅速吸收,给药后1至2小时内达到血浆峰浓度(Cmax)。根据人中一项物料平衡研究,ruxolitinib的口服吸收估计至少95%。跨越单剂量5至200 mg剂量范围平均ruxolitinibCmax和总暴露(AUC)正比例增加。Jakafi与高脂肪餐给药ruxolitinib的药代动力学无临床意义变化,平均Cmax中度减低(24%)和平均AUC接近无变化(增加4%)。
分布
在骨髓纤维化患者中稳态时ruxolitinib表观分布容积是53至65 L。体外与血浆蛋白结合是约97%,大多数与白蛋白。
代谢
体外研究提示CYP3A4是负责ruxolitinib代谢的主要酶。在人中Ruxolitinib是在循环中优势的实体代表约60%药物-相关物质。在健康受试者血浆中鉴定两个主要和活性代谢物代表母药AUC的25%和11%。这些两个代谢物分别有ruxolitinib药理学活性的1/5和一半。The sum total of所有活性代谢物贡献的总和为总体 ruxolitinib药效学的18%。
消除
在健康受试者中单次口服剂量[14C]-标记ruxolitinib后,消除是主要通过代谢有74%放射性在尿中排泄和22%经粪排泄。未变化药物占排泄总放射性的小于1%。Ruxolitinib的平均消除半衰期约3小时和ruxolitinib +代谢物平均半衰期约5.8小时。
年龄,性别,或种族的影响
在健康受试者中,观察到ruxolitinib的药代动力学关于性别和种族无明显差别。在骨髓纤维化患者中一项群体药代动力学评价,表观口服清除率和患者年龄,或种族间无明显相互关系,和妇女中清除率为17.7L/h和男性22.1 L/h与39%受试者间变异性。
药物相互作用
在体外,ruxolitinib及其M18代谢物不是CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6或CYP3A4的抑制剂。在临床相关浓度Ruxolitinib不是CYP1A2,CYP2B6或CYP3A4的诱导剂。
在体外,ruxolitinib及其M18代谢物在临床相关浓度不是P-gp,BCRP,OATP1B1,OATP1B3,OCT1,OCT2,OAT1或OAT3转运系统的抑制剂。Ruxolitinib不是P-gp转运蛋白的底物。
12.4QT的彻底研究
在一项47例健康受试者随机化,安慰剂-,和阳性-对照(莫西沙星[moxifloxacin] 400mg)四-阶段交叉彻底QT研究中评价单剂量ruxolitinib 25 mg和200mg对QTc间期的影响。在一项研究检测小效应的证实能力,根据Fridericia校正法(QTcF)的最大安慰剂校正,基线-校正QTc单侧95%可信区间上限是低于10 ms,监管关注的阈值。200 mg剂量足以代表高风险的临床情况。
13. 非临床毒理学
13.1.癌发生,突变发生,生育力受损
在6个月Tg.rasH2转基因小鼠模型中Ruxolitinib不是致癌剂。正在大鼠进行一项2-年致癌性研究。
Ruxolitinib在一项细菌致突变性试验(Ames试验)不是致突变剂或体外染色体畸变试验(培养人外周血淋巴细胞)或体内大鼠骨髓微核试验不是致染色体断裂。
在一项生育能力研究中,在交配前和整个交配期被给予雄性大鼠和交配前和直至植入天(妊娠第7天)给予雌性大鼠ruxolitinib。在剂量10,30或60 mg/kg/day,Ruxolitinib对雄性和雌性大鼠生育能力或生殖功能无影响。 但是,在雌性大鼠剂量大于或等于30mg/kg/day导致植入后丢失增加。在30 mg/kg/day剂量时的暴露(AUC)约为人最大推荐剂量25mg每天2次时临床暴露的34%。
14. 临床研究
在有骨髓纤维化患者中(或原发性骨髓纤维化,真性红细胞增多症后骨髓纤维化或原发性血小板减少症后-骨髓纤维化)进行两项随机化3期研究(研究1和2)。在两项研究中,有肋缘下可触及脾肿大至少5cm患者和根据国际工作组共识标准(IWG)风险类别中间2(预后因子2)或高危(预后因子3或更高)。
Jakafi的开始剂量是根据血小板计数。血小板计数100和200/μL间患者开始用Jakafi 15mg每天2次和血小板计数大于200/μL患者开始用Jakafi 20mg每天2次。然后根据耐受性和疗效剂量按个体化,对血小板计数100至小于或等于125/μL间患者用最大20mg每天2次剂量,对血小板计数75至小于或等于100/μL间患者用10mg每天2次,和对血小板计数s间50至小于或等于75/μL患者用5 mg每天2次。
研究1
研究1是一项在309例对可得到治疗难治或不是备选者患者双盲,随机化,安慰剂-对照研究。中位年龄为68岁(范围40至91岁)有61%患者大于65岁和54%为男性。50%患者有原发性骨髓纤维化,31%有真性红细胞增多症后骨髓纤维化和18%有原发性血小板增多症后骨髓纤维化。21%患者在纳入研究8周内有红细胞输血。中位血红蛋白计数为10.5 g/dL和中位血小板计数为251/μL。患者肋缘下有可触摸到中位脾长度16cm,81%在肋缘下有脾长度10cm或更长。用核磁共振影像(MRI)或计算机化断层拓扑影像(CT)测量患者有中位脾体积为2595立方厘米(范围478立方厘米至8881立方厘米)。(正常上限为约300立方厘米)。
患者被给予Jakafi或匹配安慰剂。主要疗效终点为在24周时用MRI或CT测量脾体积从基线减低达到大于或等于35%的患者比例。
次要终点包括脾体积减低35%或更大的时间和用改良骨髓纤维化症状评估表(MFSAF)v2.0日记测量总症状评分从基线至24周减低有50%或更大的患者比例。
研究2
研究2是一项在219例患者中开放,随机化研究。患者以2:1被随机化至Jakafi相比可得到最佳治疗。由研究者在患者-与-患者基础上选择可得到最佳治疗。在可得到最佳治疗组,10%以上患者接受药物为羟基脲[hydroxyurea](47%)和糖皮质激素(16%)。中位年龄为66岁(范围35至85岁)有52%患者大于65岁和57%为男性。53%患者有原发性骨髓纤维化,31%有真性红细胞增多症后骨髓纤维化和16%有原发性血小板增多症后骨髓纤维化。21%患者纳入本研究8周内曾输注红细胞。中位血红蛋白计数为10.4g/dL和中位血小板计数为236/μL。患者在肋缘下有可触摸到脾长度中位15 cm,有70%患者肋缘下脾长度10cm或以上。用MRI或CT测量患者有中位脾体积2381立方厘米(范围451立方厘米至7765立方厘米)。
主要疗效终点为在48周时用MRI或CT测量脾体积从基线减低达到35%或以上的患者比例。
研究2中次要终点为从基线至24周用MRI或CT测量脾体积减低达到35%或以上的患者比例。
研究1和2疗效结果
下面表6中展示研究1和2中主要终点的疗效分析。两研究在Jakafi组中,研究1与安慰剂和研究2与可得到最佳治疗比较,脾体积从基线减低达到35%或以上的患者比例显著较多。在Jakafi组中可触摸到脾脏长度减低达到50%或以上患者比例也与之相似。
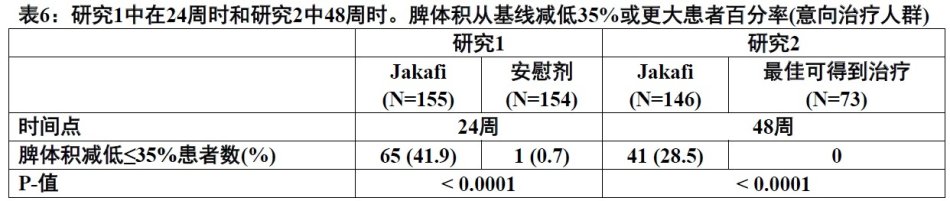
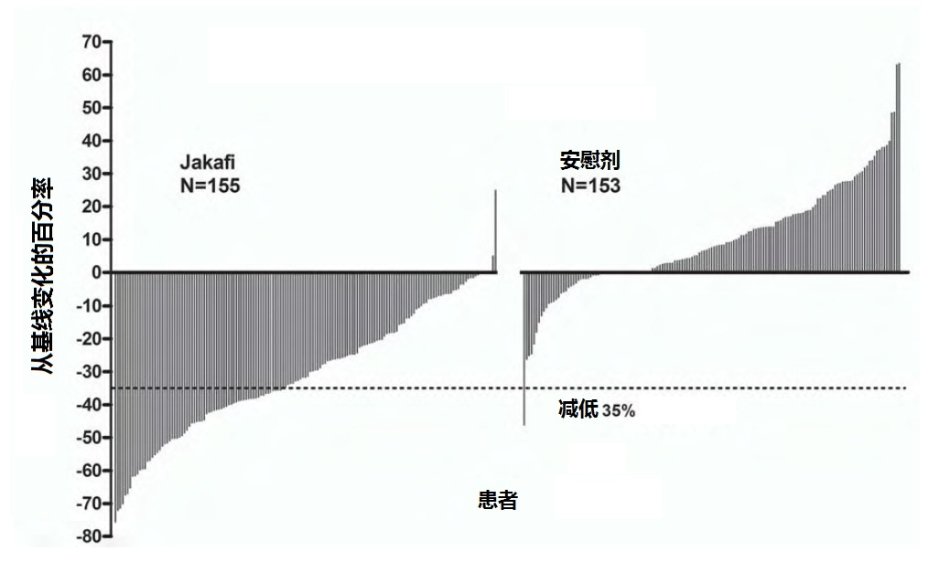
图1: 对每例患者在24周或最末观察时脾体积从基线变化百分率(研究1)
在研究1中,骨髓纤维化症状为次要终点和用改良的骨髓纤维化症状评估表(MFSAF)版本v2.0日记测量。改良的MFSAF是一种捕获骨髓纤维化核心症状(腹部不适,左肋下疼痛,夜汗,瘙痒,骨/肌肉痛和早饱)的每天日记。捕获范围从0至10范围的症状评分,其中0代表“无”症状和10代表“想像最坏的”症状。这些评分相加创建每天总评分,最大为60。
表7代表在研究1中从基线至24周总症状评分的评估,包括至少减低50%(即,症状改善)患者的比例。在Jakafi组基线时平均总症状评分为18.0和安慰剂组16.5。Jakafi组中总症状评分减低50%或以上患者比例比安慰剂组较高,有中位反应时间小于4周。

图2:在24周时或最末观察对每例患者总症状评分从基线变化百分率(研究1)
图2显示在24周时(JakafiN=129,安慰剂N=103)或最末评价对随机化治疗前至第24周时对患者未完成24周随机化治疗(JakafiN=16,安慰剂N=42)每例患者总症状评分从基线变化百分率。结果排除基线总症状评分为零的5例患者,8例丢失基线患者和基线后数据不充分的6例患者的结果。
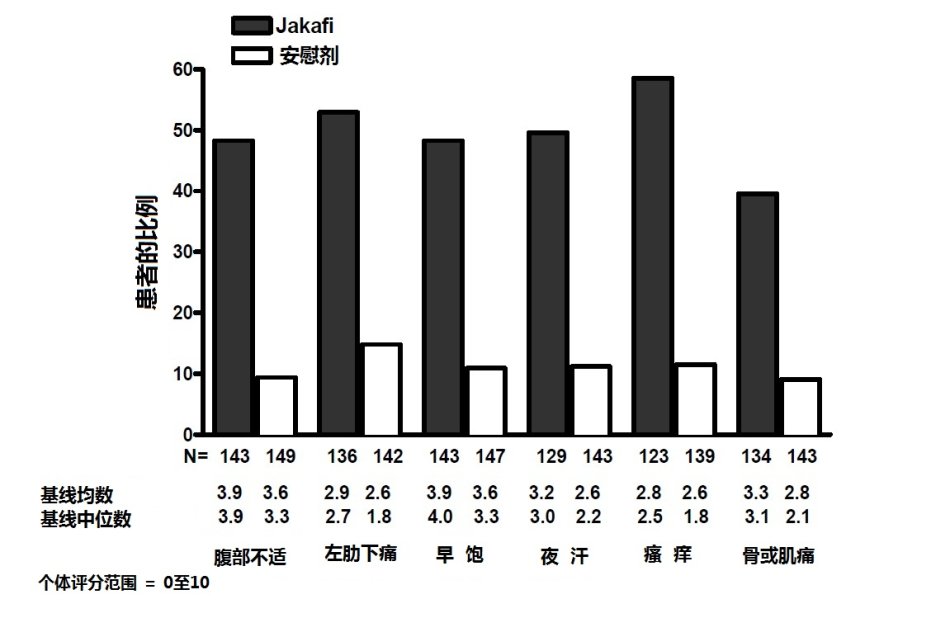
图3:在24周时个体症状评分有50%或更大患者的比例。
16. 如何供应贮存和处置
可得到Jakafi (ruxolitinib)片如下:
贮存在室温20°C至25°C(68°F至77°F);外出允许15°C和30°C间(59°F和86°F) [见USP控制室温]。
17. 患者咨询资料
见FDA-批准患者使用说明书(患者资料).
建议医生和健康保健人员用Jakafi治疗前与患者讨论以下:
17.1血小板计数减低,贫血和中性粒细胞减少
告知患者Jakafi伴有血小板计数减低,贫血和中性粒细胞减少,和治疗前和治疗期间需监视完全血细胞计数。
17.2 感染
应告知患者感染的体征和症状和应立即报告任何这类体征和症状。
应告知患者带状疱疹的早期体征和症状,劝告应尽可能早寻求治疗。
17.3药物-药物相互作用
劝告患者告知他们的健康保健提供者他们服药所有药物,包括非处方药,草药和每天补充物。
17.4 透析
告知进行透析患者,他们的剂量不应在透析前服用但只在透析后使用。
17.5 医从性
建议患者每天连续服用Jakafi长如医生所述和这是一种长期治疗。没有首先咨询医生,患者不应改变剂量或停止服用Jakafi。患者应认识到终止治疗后, 骨髓纤维化体征和症状预期将恢复。

