13价肺炎球菌结合疫苗(Prevnar 13)使用说明书2011年12月版
批准日期2011年12月30日;公司:Wyeth药业
FDA的生物制品评价和研究主任Karen Midthun,M.D.说“按照美国最近信息,估计约300,000的50岁和以上成年每年因为肺炎球菌肺炎住院”,“肺炎球菌疾病是疾病和死亡的实质原因。今天的批准提供另一种疫苗为在这个年龄组预防肺炎球菌肺炎和侵入性疾病。”
在监督管理局加速批准途径下批准Prevnar 13的新用途,允许早期批准严重和危及生命疾病。通路允许用合理预测临床获益的免疫标志物显示疫苗有效性。
加速批准是授予该疫苗批准上市后期间条件下进行一项临床试验证实期望的临床获益。一项另外试验在既往没有接受Pneumovax23史的85,000年龄65岁和以上人, 正在进行证实Prevnar 13预防肺炎球菌肺炎的临床获益。
Prevnar13为50岁和以上成年的批准支持美国卫生和人类服务部的2020目标
http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM201669.pdf
处方资料重点
这些重点不包括安全和有效使用PREVNAR13所需所有资料。请参阅PREVNAR13的完整处方资料
为肌肉注射悬液
美国初始批准: 2010
最近重要修改
适应证和用途(1) 01/2012
剂量和给药方法,免疫接种时间表为50岁和以上成年 (2.6)01/2012
适应证和用途
在6周至5岁儿童中(第6次生日前),Prevnar 13是一种疫苗适用于:
(1)主动免疫预防链球菌肺炎血清型1,3,4,5,6A,6B,7F,9V,14,18C,19A,19F和23F所致侵入性疾病。
(2)主动免疫为预防链球菌肺炎血清型4,6B,9V,14,18C,19F,和23F所致中耳炎。对血清型1,3,5,6A,7F,和19A未能得到中耳炎疗效资料。(1.1)
在50岁和以上成年中,Prevnar13是一种疫苗适用于:
(1)为预防链球菌肺炎血清型1,3,4,5,6A,6B,7F,9V,14,18C,19A,19F和23F所致肺炎和侵入性疾病主动免疫。该适应证是根据用Prevnar13引发免疫反应。在成年中没有对照试验证实用 Prevnar13免疫接种后肺炎球菌肺炎或侵入性疾病减低。(1.2)
使用限制
(1)Prevnar13将不保护未包括在疫苗中链球菌肺炎血清型所致疾病。 (1.3)
(2)不知道 肺炎球菌多糖疫苗Prevnar13接种后小于5年有效性。 (1.3)
剂量和给药方法
6周至5岁儿童:四-剂量系列免疫接种由在2,4,6,和12-15月龄0.5 mL肌肉注射接种组成。 (2.3)
50岁和以上成年:单剂量。(2.6)
剂型和规格
0.5 mL肌肉注射悬液,在单-剂量预装注射器内提供。 (3)
禁忌证
对Prevnar 13任何组分或含任何白喉类毒素疫苗严重过敏反应(如,过敏反应)。(4)
警告和注意事项
在一些早产婴儿中肌肉内免疫接种后曾观察到无呼吸。关于当给予肌肉疫苗时决策,包括Prevnar13,至早产婴儿应根据个体婴儿医学状态,和潜在获益和免疫接种的可能风险考虑。(5.3)
不良反应
在2,4,6,和12-15月龄婴儿和幼儿中接种美国的临床试验中,最常报道诱发不良反应是过敏性(>70%),注射部位压痛(>50%),食欲减低(>40%),睡眠减少(>40%), 睡眠增加(>40%),发热(>20%),注射部位发红(>20%),和注射部位肿胀(>20%)。(6.1)
在50岁和以上成年中最常报道诱发不良反应是注射部位疼痛(>50%),疲乏(>30%),头痛(>20%),肌肉痛(>20%),关节痛(>10%),食欲减低(>10%),注射部位发红(>10%),注射部位肿胀(>10%),手臂运动受限(>10%),畏寒(>5%)或皮疹(>5%)。(6.2)
为报告怀疑不良反应,联系WyethPharmaceuticals公司电话1-800-438-1985或VAERS电话1-800-822-7967或http://vaers.hhs.gov。
药物相互作用
成年中,对Prevnar 13的抗体反应消失当给予灭活流感病毒疫苗。(14.3)
特殊人群中使用
妊娠: 尚未确定Prevnar 13在妊娠妇女中的安全性和有效性。(8.1)
儿童使用:尚未确定Prevnar 13在小于6周龄或第6生日后儿童中安全性和有效性。 (8.4)
老年人使用:在>65岁人中对Prevnar13的抗体反应比50至59 岁人对的抗体反应较低。 (8.5)
完整处方资料
1适应证和用途
1.1 6周至5岁龄儿童
在6周至5岁龄儿童(第6次生日前),Prevnar 13是适用于:
(1)主动免疫预防链球菌肺炎血清型1,3,4,5,6A,6B,7F,9V,14,18C,19A,19F和23F所致侵入性疾病。
(2)主动免疫为预防链球菌肺炎血清型4,6B,9V,14,18C,19F,和23F所致中耳炎。对血清型1,3,5,6A,7F,和19A中耳炎疗效无可供利用资料。
1.2 50岁和以上成年
50岁和以上成年中,Prevnar13是适用于:
(1)主动免疫为预防肺炎和侵入性疾病所致链球菌肺炎血清型1,3,4,5,6A,6B,7F,9V,14,18C,19A,19F和23F。这个适应证是给予被Prevnar13引发的免疫反应。在成年中没有对照试验证实免疫接种Prevnar13后侵入性肺炎球菌疾病或肺炎球菌肺炎减低。.
1.3 Prevnar 13使用的局限性和有效性
Prevnar13将不保护疫苗中不含链球菌肺炎血清型所致的疾病。
不知道给予Pneumovax23®(肺炎球菌疫苗多价, PPSV23)后小于5年给Prevnar13的有效性[见临床试验14.3]。
2剂量和给药方法
2.1为给药制备
因为本产品是含赋形剂的悬液,在得到疫苗容器内均匀,白色悬液后,用前立即剧烈摇动。如不能重新悬浮不要使用疫苗。非肠道药品在给予前应肉眼观测有无颗粒物质和变色[见一般描述(11)]。如发现颗粒物质和变色不应使用产品。
不要在相同注射器内混合Prevnar 13与其它疫苗/产品。
2.2给药信息
仅为肌肉注射。不要静脉,皮内,或皮下注射。
用无菌针头附着在供应的预装注射器肌肉注射每0.5mL剂量。婴儿中最好的注射部位是大腿前外侧而幼儿,青少年和成年是上臂三角肌。不应将疫苗注入臀区或可能是主要神经干和/或血管的区域。
2.3为婴儿和幼儿免疫接种时间表
Prevnar 13将以四剂系列在2,4,6,和12-15月龄给予。

2.4 对 ≥7月龄未接种儿童免疫接种时间表
对超出常规婴儿时间表年龄范围儿童和没有接受Prevnar®或Prevnar 13,应用下列追赶时间表。
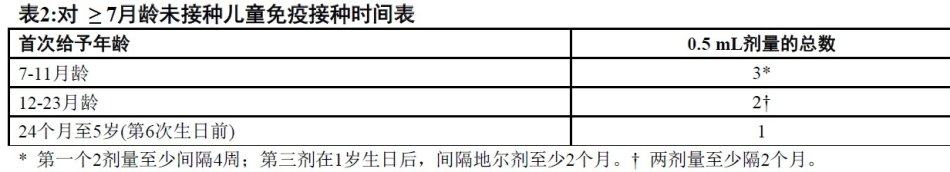
这个追赶时间表诱发的免疫反应对某些血清型可能导致抗体浓度比4剂Prevnar13(在2,4,6,和12至15个月给予)后抗体浓度较低。在24个月至5岁儿童中,追赶时间表对某些血清型可能导致抗体浓度比三剂Prevnar13(在2,4,和6个月给予)后抗体浓较低。
2.5对既往接种疫苗用Prevnar肺炎球菌7-价组合疫苗(白喉CRM197蛋白)儿童免疫接种时间表
曾接受一剂或更多剂Prevnar儿童可能完成用Prevnar13免疫接种系列。15个月至5岁儿童被认为完全免疫可能接受一剂对6种附加血清型用Prevnar13引发免疫反应。这种追赶(补充)剂量Prevnar 13应在最后剂量Prevnar后至少间隔8周给予。这个Prevnar13时间表诱发免疫反应可能对6种另外血清型(类型1,3,5,6A,7F,和19A),导致抗体浓度比4剂Prevnar13后(在2,4,6,和12至15 个月给予)抗体浓度较低。
2.6 为50岁和以上成年免疫接种时间表
Prevnar13作为单剂量给予。
7药物相互作用
7.1同时免疫接种
在用婴儿和幼儿临床试验中,Prevnar13同时给予以下美国许可的疫苗:Pediarix[白喉和破伤风类毒素和非细胞百日咳吸附,乙型肝炎(重组)和灭活脊髓灰质炎病毒疫苗组合](DTaP-HBV-IPV)和ActHIB[嗜血杆菌b结合疫苗(破伤风类毒素(结合)](PRP-T)对头三剂和用PedvaxHIB[嗜血杆菌b结合疫苗(脑膜炎双球菌蛋白结合)](PRP-OMP),M-M-RII[麻疹,流行性腮腺炎,风疹病毒疫苗活](MMR)和Varivax[水痘病毒疫苗活],或ProQuad[麻疹,流行性腮腺炎,风疹病毒疫苗活](MMRV)和VAQTA[甲肝疫苗,灭活](HepA)对4剂[见临床试验(14.2)]。
在成年中,Prevnar13与对2007/2008对流感季节美国许可Fluarix(TIV)同时给予时[见临床试验(14.3)]。没有Prevnar13与含白喉类毒素疫苗和对在50岁和以上成年许可使用许可其它疫苗同时给药的资料。
当与Prevnar 13给予相同时间给予另一个可注射疫苗(s)时,应总是用不同注射器和在不同注射部位给予。
不要在相同注射器中将Prevnar 13与其它疫苗/产品混合。
以下各节省略
3 剂型和规格
4 禁忌证
5 警告和注意事项
5.1 过敏反应的处理
5.2 免疫活性改变
5.3 早产婴儿中无呼吸
6 不良反应
6.1 在婴儿和幼儿中用Prevnar 13临床试验经验
6.2 在成年中年龄 ≥50岁用 Prevnar 13临床试验经验
6.3 在婴儿和幼儿中用Prevnar临床试验经验
6.4 在婴儿和幼儿中用Prevnar上市后经验
7 药物相互作用经验
7.1 同时免疫
7.2 免疫抑制治疗
8 特殊人群中使用
8.1 妊娠
8.3 哺乳母亲
8.4 儿童使用
8.5 老年人使用
11 一般描述
12 临床药理学
12.1 作用机制
14 临床研究
14.1 Prevnar疗效资料
14.2 在婴儿和幼儿中Prevnar 13有效性的评价
省略以上各节
14.3 Prevnar13在成年中免疫原性临床试验
在美国和欧洲在不同成年年龄组中,在曾或未曾既往接种PPSV23疫苗(未接种PPSV23)或曾接受一剂PPSV23(既往接种PPSV23疫苗)个体中进行五项3期临床试验评价Prevnar13的免疫原性。
每项研究包括健康成年和有稳定的患病情况免疫功能受损成年包括慢性心血管病,慢性肺部疾病,肾病,糖尿病,慢性肝病,和医学风险情况和行为(如酗酒和吸烟)已知增加严重肺炎球菌肺炎和侵入性肺炎球菌疾病的风险。稳定医学情况被定义为研究疫苗接受者在12周前治疗不需要明显改变的医学情况(即,由于疾病恶化改变为新治疗)或疾病恶化住院。
用一种mcOPA分析(注:用细菌微集落计数活细菌细胞数,OPA antibody,为调理吞噬抗体,opsonophagocyticantibody,血清中一种抗体或补体产物的激活引起细菌或其它外来细胞对吞噬细胞的作用更易感=一种调理素,用流式细胞仪分析)测量Prevnar13和PPSV23引发的免疫反应为Prevnar13中所含的13种肺炎球菌血清型。每种疫苗接种后1个月计算测量的血清型-特异性OPA滴度的几何均数(GMTs)。对两种疫苗共有的12种血清型,如GMT比值的2-侧95%可信区间(CI)的低限(Prevnar13/PPSV23)大于0.5则符合疫苗间非劣效性。
另外对血清型6A的反应,在Prevnar 13中含有但PPSV23中不含有,以上免疫接种前水平,评估抗-6AOPA滴度显示增加4-倍。被确定对Prevnar 13统计上显著较大反应,成年的百分率的差异(Prevnar 13减去PPSV23)抗-6A OPA滴度达到增加4-倍,因95% CI 2-侧的低限大于零。对OPAGMTs的比较,对血清型6A统计上较大反应被定义为GMT比值(Prevnar 13/PPSV23)的95% CI2-侧低限大于2。
在五项3期临床试验中,进行2项非劣效性试验其中对Prevnar13免疫反应与对PPSV23免疫反应比较;一项在未接种PPSV23年龄50至64岁成年(研究1),和一项在年龄 ≥70岁成年PPSV23疫苗接种前(研究2)。第三项研究在纳入时PPSV23未接种年龄60至64岁成年中比较Prevnar13单剂量免疫反应与对Prevnar13给予一年后一剂量PPSV23反应(研究3)。研究还比较单剂量PPSV23的免疫反应与对PPSV23给予一年后一个剂量Prevnar13的反应比较。两项研究在美国(研究5)和欧洲(研究6)评估同时给予Prevnar13与季节性灭活流感疫苗Fluarix(TIV)。
在未接种PPSV23成年中进行临床试验
在一项在美国Prevnar13的阳性对照修饰双盲临床试验(研究1),未接种PPSV23年龄60至64岁成年被随机赋予(1:1)接受Prevnar13或PPSV23。此外,纳入年龄50至59岁成年和接受一剂Prevnar 13(开放试验)。
在年龄60至64岁成年中,对两种疫苗均常见12种血清型,Prevnar13引发OPA抗体GMTs是不劣于于被PPSV23引发的OPA抗体GMTs(见表19)。此外,对8种常见血清型,对OPAGMT比值(Prevnar 13/PPSV23)的95%可信区间的低限是大于1。
在PPSV23-未接种疫苗年龄60至64岁成年中,对Prevnar 13独特的血清型6A,在Prevnar13后有增加4-倍受试者的比例(88.5%)是统计上显著大于PPSV23后(39.2%)。Prevnar13后与PPSV23后比较对血清型6A的OPA GMTs是统计上显著较大(见表19)。

年龄50至59岁成年中Prevnar13引发OPA抗体GMTs是不劣于年龄60至64岁成年中对所有13种血清型对Prevnar13引发相应OPA抗体GMTs(见表19)。
a修饰的双盲意味著地点工作人员非盲态发放和给予疫苗,但所有其它研究人员包括主要研究者和受试者均为盲态。
既往接种疫苗PPSV23成年中进行临床试验
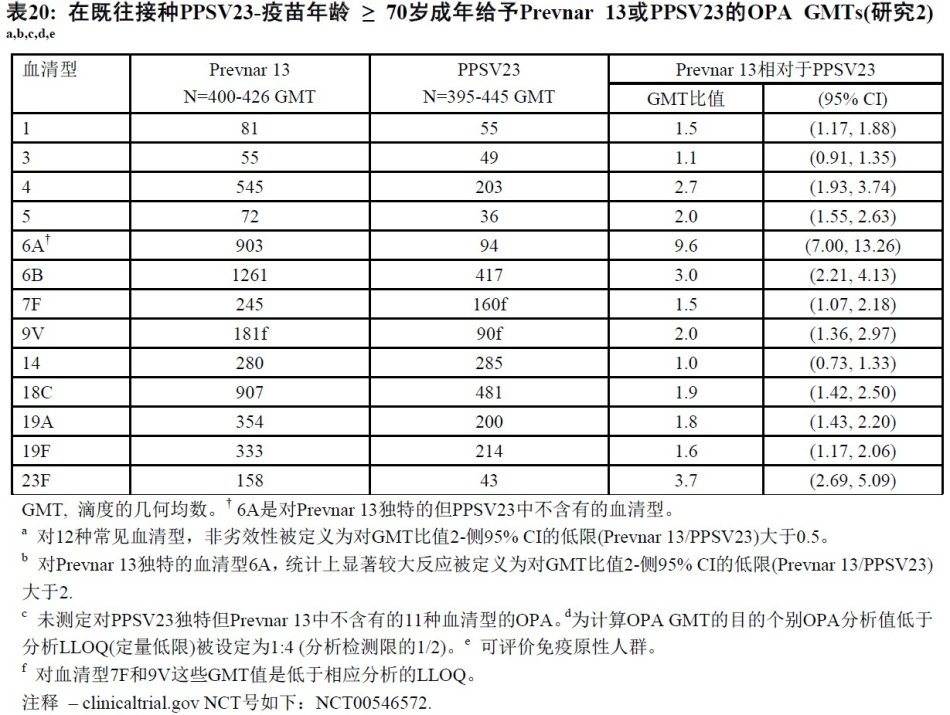
在美国和瑞典Prevnar13的一项3期阳性对照,修饰双盲临床试验(研究2),PPSV23疫苗接种前年龄 ≥ 70岁成年曾接受一剂PPSV23 ≥ 5年前被随机赋予(1:1)接受或Prevnar 13或PPSV23。
对12中常见血清型Prevnar13引发OPA抗体GMTs是不劣于被PPSV23引发OPA抗体GMTs,当既往剂量PPSV23后最少5年时给予Prevnar13或PPSV23。此外,对10种常见血清型对OPA GMT比值(Prevnar13/PPSV23)95%可信区间的低限是大于1。
在PPSV23-前疫苗接种年龄 ≥70岁成年中,Prevnar13后对Prevnar独特的血清型6A的OPA滴度增加4-倍的受试者比例(71.1%),是统计上显著大于PPSV23后(27.3%).Prevnar13后与PPSV23后比较,对血清型6A的OPAGMTs是统计上显著较大。
这个临床试验证实在年龄 ≥ 70岁成年和≥5年以前前接种疫苗PPSV23,用Prevnar13疫苗接种当与再次-疫苗接种PPSV23比较引发不劣于免疫反应(见表20)。
在未接种PPSV23成年中顺序疫苗接种Prevnar13和PPSV23的临床试验
在未接种-PPSV23疫苗60至64岁成年进行一项随机化临床试验(研究3),223人接受PPSV23接着一年后Prevnar13(PPSV23/Prevnar 13),和478人只接受Prevnar 13。表21中显示Prevnar13疫苗接种用后一个月测定的OPA抗体滴度。Prevnar 13一年后接受PPSV23当与单独接受Prevnar 13比较,OPAGMTs抗体滴度减弱 。相似地,在研究2中≥ 70岁成年PPSV23-前-接种疫苗的开拓分析,Prevnar13一年后接受PPSV23当与单独接受Prevnar 13比较观察到OPA GMTs减弱。
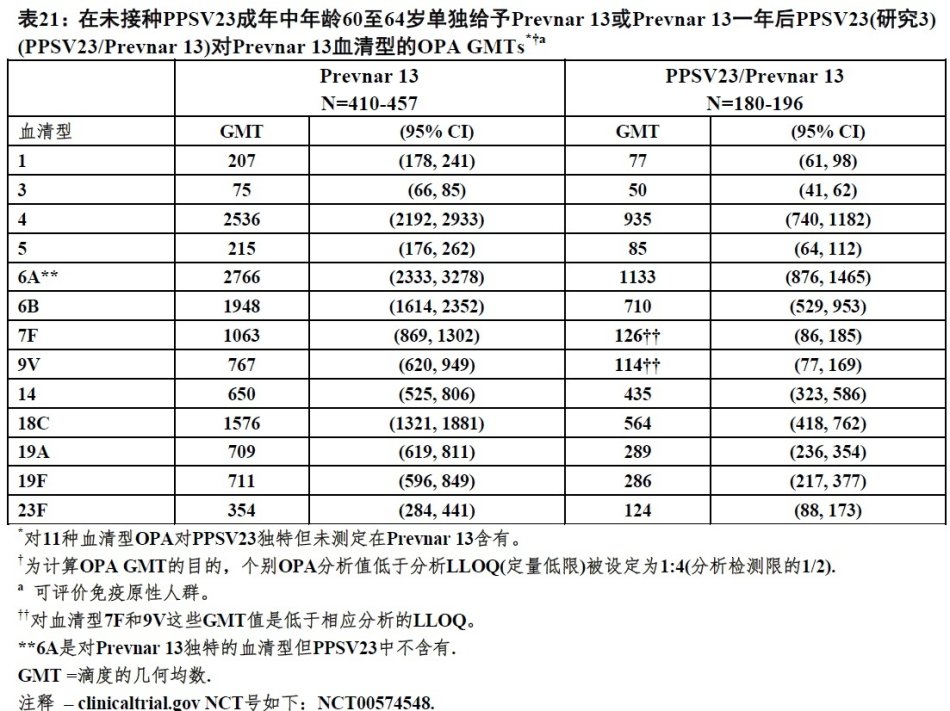
给药间隔大于1年没有可供利用资料。既往未接种人对Prevnar13给予一年后PPSV23反应无可供利用资料。
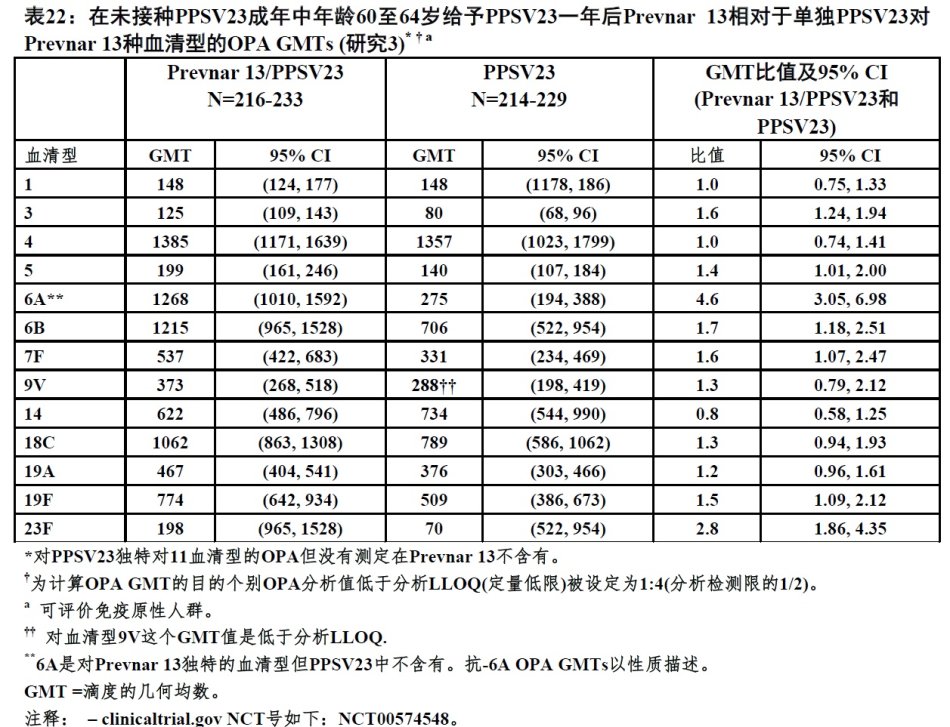
还在研究3中,266人接受Prevnar 13接着一年后PPSV23(Prevnar 13/PPSV23)。Prevnar13后一年给予PPSV23 (Prevnar13/PPSV23)OPA抗体GMTs是不劣于单剂量PPSV23后(N=237),对12种常见血清型[对GMT比值95%CI的低限[Prevnar 13/PPSV23相对于PPSV23]是 >0.5](见表22)。在研究1中,第一天PPSV23-未接种疫苗60至64岁成年进行,108人PCV13后3.5至4年接受PPSV23(Prevnar13/PPSV23)和414人接受单剂量PPSV23。在研究3中[(Prevnar13/PPSV23)/PPSV23]与一年给药间隔比较一般观察到较高血清型-特异性OPA GMT比值。
在未接种PPSV23成年中评估Prevnar13与季节性三价灭活流感疫苗(TIV)给予临床试验
两项在未接种PPSV23成年中年龄50至59岁(研究5,在美国进行)和in成年≥65岁(研究6,在欧洲进行)随机化,双盲临床试验与灭活TIV(秋季2007/春季2008 Fluarix,A/H1N1,A/H3N2,和B株)给予评价Prevnar 13的免疫原性。
在各个临床试验中一组同时接受Prevnar13和TIV,接着约一个月后安慰剂。其它组同时接受TIV和安慰剂,接着约一个月后Prevnar13。
TIV疫苗接种后一个月,用红细胞凝集抑制分析(HAI)测定TIV引发抗体反应。疫苗接种后一个月评价对每个TIV株在HAI滴度增加达到≥4-倍(有反应者)的受试者比例。对每个TIV疫苗抗原如有反应者的比例两组间(同时减去(TIV+Placebo))95%CI的低限的差别是大于-10%是证实非劣效性。
在50至59岁受试者中,在Prevnar13后给予3株TIV株各株与TIV同时给予与单独给TIV比较显示非劣效性。
在≥65岁受试者中,显示对A/H1N1和B-株非劣效性,但不是对A/H3N2,对95%CI低限-10.4%。
当Prevnar13被与TIV同时给予与单独给予Prevnar 13比较时,研究还评估Prevnar 13的抗体反应。Prevnar13疫苗接种后一个月,在一子组受试者中,用ELISA IgG测量抗多糖结合抗体反应(IgG)。如2-侧,95% CI对IgGGMC比值(Prevnar 13+ TIV相对于单独Prevnar 13)的低限是 >0.5证实非劣效性。在一项事后分析中,用相同标准评价OPA抗体反应(调理吞噬抗体,opsonophagocyticantibody,注:血清中一种抗体或补体产物的激活引起细菌或其它外来细胞对吞噬细胞的作用更易感=一种调理素)。
在50至59岁受试者中,当用ELISA测量,Prevnar 13 IgG抗体反应, Prevnar13被与TIV同时给予后与单独给予Prevnar 13比较对全部13血清型符合非劣效性,而观察到对8/13血清型OPAGMT比值的非劣效性。
在≥65岁受试者中,当用ELISA测量,Prevnar 13 IgG抗体反应, Prevnar13被与TIV同时给予后与单独给予Prevnar 13比较对12/13中血清型符合非劣效性,和观察到对10/13血清型OPAGMT比值的非劣效性。

