Multaq(决奈达隆,dronedarone)片使用说明书2009年12月版
批准日期:美国FDA,2009年7月1日http://www.accessdata.fda.gov/drugsatfda_docs/label/2009/022425lbl.pdf
欧盟EMEA 2009年12月16日;http://www.ema.europa.eu/humandocs/PDFs/EPAR/multaq/h-1043-en1.pdf
公司:Sanofi-aventis

11 一般描述:
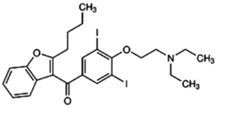
盐酸决奈达隆是苯并呋喃衍生物。化学名:N-2-butyl-3-[4-(3-dibutylaminopropoxy)benzoyl]benzofuran-5-yl methanesulfonamide,hydrochloride。分子式C31H44N2O5S?HCl,分子量593.2。结构式:
1 适应证:
决奈达隆是抗心律失常药物,适用于阵发性或持续性心房颤动(AF)或心房扑动(AFL)患者,减低住院风险,近期AF/AFL发作和伴心血管风险因子患者(即年龄>70、高血压、糖尿病、既往心血管意外、左心房直径≥50mm或左心室射血分数[LVEF]<40%),窦性心律或心律可复律的患者。
2 剂量和用法:
每天2次,早和晚餐各1片400 mg。
4 禁忌证:
1.心衰类别IV或最近失代偿症状性心衰;
2.II-或III-度房室(AV)阻断或病态窦房结综合征(除使用功能性心脏起搏器);
3.心动过缓<50 bpm;
4.同时用强CYP3A抑制剂;
5. 同时用延长QT间隔及可诱发尖端扭转型室性心动过速(Torsade de Pointes)药物和草药;
6. QTc Bazett间隔( )≥500 ms;
7. 严重肝损伤;
8.妊娠;
9. 哺乳母亲。
6 不良反应
在说明书中任何处描述担忧下列安全性:
1)新心衰或心衰恶化[见警告和注意事项(5.1)]
2)钾消耗利尿药的低钾血症和低镁血症[见警告和注意事项(5.2)]
3)QT延长[见警告和注意事项(5.3)]
在AF或AFL患者每天2次400mg决奈达隆的安全性评价是基于5项安慰剂对照研究,ATHENA,EURIDIS,ADONIS,ERATO和DAFNE。这些研究中,总共6285例患者被随机化和治疗,3282例患者用MULTAQ400 mg每天2次,和2875例用安慰剂。跨研究平均暴露为12个月。ATHENA最长随访为30个月。
在临床试验中,因为不良反应过早停药,决奈达隆-治疗患者发生11.8%和安慰剂-治疗组7.7%。用MULTAQ治疗停药的最常见原因是胃肠道疾患(3.2%相比安慰剂组)和QT延长(1.5%相比安慰剂组0.5%)。
在5项研究用MULTAQ每天2次400 mg观察到最频不良反应为腹泻、恶心、腹痛、呕吐和虚弱。
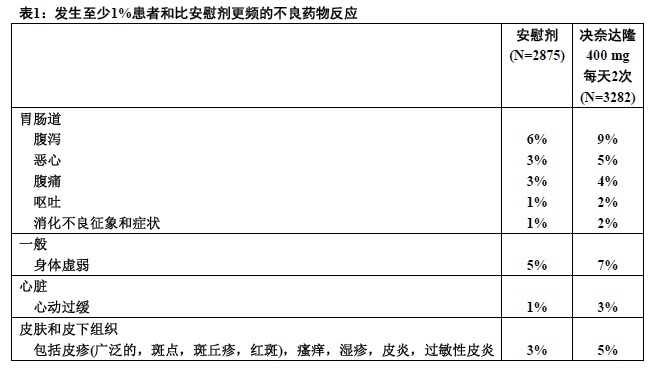
表1显示在AF或AFL患者用决奈达隆每天2次400mg比用安慰剂更常见不良反应,按系统器官类别和频度下降顺序列出。表2列举不良实验室和ECG效应。
用MULTAQ治疗患者还曾报道发生率低于1%的光敏反应和味觉异常。
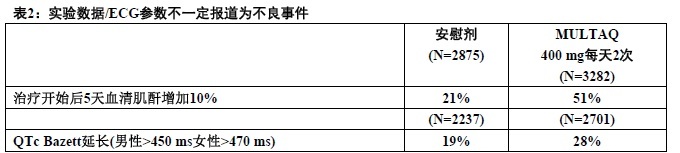
用MULTAQ每天2次400 mg报道下列实验数据/ECG参数。
人口统计因子例如性别或年龄对治疗出现不良事件的评估未提示任何特殊子组不良事件过多。
12 临床药理学
12.1作用机制
决奈达隆的作用机制未知。决奈达隆有抗心律失常性质属于所有四种Vaughan-Williams类别,但这些活动各自对临床效应的贡献不知道。
12.2 药效学
电生理效应
决奈达隆表现出所有四种Vaughn-Williams抗心律失常类别的性质,尽管不清楚其中那个对决奈达隆产生的临床效应重要。健康受试者重复口服剂量达1600mg每天次或800 mg每天2次共14天和1600mg每天2次共10天后研究决奈达隆对12-导联ECG参数(心率,PR,和QTc)的影响。决奈达隆400mg每天2次组,对心率无明显影响;在800 mg每天2次注意到中度心率降低效应(约4bpm)。对PR-间隔有明确的剂量-依赖效应,400 mg每天2次增加+5 ms和1600 mg每天2次增至+50ms。对QTc-间隔有中度剂量相关效应,400 mg每天2次延长+10 ms而1600 mg每天2次达+25 ms。
DAFNE研究
DAFNE是在复发性AF患者中的一项剂量-反应研究,比较评价决奈达隆与安慰剂维持窦性心律的效应。在本研究中决奈达隆的剂量为400,600和800mg每天2次。这个小研究中超过400 mg剂量效应不是更有效而耐受较差。
12.3 药代动力学
决奈达隆被广泛代谢和有低全身生物利用度;进餐其生物利用度增加。消除半衰期是13-19小时。
吸收
因为体循环前首过代谢,无食物时决奈达隆的绝对生物利用度是低,约4%。当决奈达隆与高脂肪餐给药增加至约15%。在食物条件下口服后3至6小时内达到血浆决奈达隆和主要循环活性代谢物(N-debutyl代谢物)峰浓度。每天2次重复给予400mg,在治疗4至8天内达到稳态和决奈达隆的平均积蓄比范围从2.6至4.5。主要N-debutyl代谢物的稳态Cmax和暴露与母体化合物相似。决奈达隆及其N-debutyl代谢物的药代动力学均中度偏离剂量正比例:剂量增加2-倍导致约2.5-至3.0-倍增加Cmax和AUC。
分布
决奈达隆及其N-debutyl代谢物的体外血浆蛋白结合是>98%和不饱和。两种化合物主要与白蛋白结合。静脉给药后稳态时分布容积约为1400 L。代谢
决奈达隆被广泛代谢,主要被CYP3A。初始通路包括N-debutylation形成形成活性N-debutyl代谢物,氧化脱氨作用形成无活性的丙酸代谢物,和直接氧化作用。各种代谢物进行进一步代谢产生超过30种未鉴定的代谢物。N-debutyl谢物表现出药效学活性但是强度为决奈达隆的1/10至1/3。
排泄/消除
用口服决奈达隆质量平衡研究中(14C-标记)约6%的标记剂量在尿中被排泄,主要为代谢物(尿中无未变化化合物排泄),而84%在粪中排泄,主要为代谢物。决奈达隆及其N-debutyl活性代谢物至少占血浆中由此产生的放射性小于15%。
静脉给药后决奈达隆的血浆清除率范围从130至150 L/h。决奈达隆的消除半衰期范围从13至19小时。
特殊人群
性别
在女性中决奈达隆的暴露平均比男性较高30%。
种族
未正式评价药代动力学种族相关的差别。然而,基于一项交叉研究比较,单剂量给药后(400 mg),亚裔男性(日本人)比高加索男性有约2-倍较高的暴露。未评估在其它种族中决奈达隆的药代动力学。
老年人
决奈达隆的临床研究中,受试者总数73%是65岁和以上而且34%是75岁和以上。患者年龄65岁和以上,决奈达隆的暴露是比小于65岁患者较高23%[见在特殊人群中的使用(8.5)]。
肝损伤
在中度肝损伤受试者相对于正常肝功能受试者平均决奈达隆暴露增加1.3-倍,而N-debutyl代谢物平均暴露减低约50%。有中度肝损伤受试者中药代动力学数据显著地更加变异。
尚未评估严重肝损伤对决奈达隆药代动力学的影响[见禁忌证(4)]。
肾损伤
与决奈达隆的低肾排泄一致,有轻或中度肾损伤受试者与正常肾功能受试者比较,未观察到药代动力学差异[见在特殊人群中的使用(8.6)]。有轻度至严重肾损伤患者与正常肾功能患者比较未观察到药代动力学差异。
14 临床研究
14.1 ATHENA研究
ATHENA是一项多中心,多国,双盲,和随机化安慰剂-对照研究 of决奈达隆在4628例有AF/AFL最近史在窦性心律或将被转换为窦性心律的患者。研究的目的是确定是否决奈达隆能延缓任何原因死亡或住院对心血管原因。
起初患者是70岁,或<70岁至少有1种风险因子(包括高血压、糖尿病、既往脑血管意外、左心房直径50mm或LVEF<0.40)。纳入标准是以后变成患者是75岁,或70岁有至少1种风险因子。既往6个月内患者必须同时有AF/AFL和窦性心律记录。在随机化时患者可能曾有AF/AFL或窦性心律,但患者不是窦性心律期望被或电学上或在抗凝后化学上转化为正常窦性心律。
受试者被随机化和治疗 for up to 30个月(随访中位:22个月) with 或每天2次MULTAQ 400 mg(2301例患者)或安慰剂(2327例患者), 除了常规治疗对心血管病that包括β-阻滞剂(71%),ACE抑制剂或血管紧张素II受体阻滞剂(ARBs)(69%), 地高辛(14%), 钙拮抗剂(14%), 他汀类药物(39%),口服抗凝药(60%), 阿司匹林(44%), 其它慢性抗血小板治疗(6%)和利尿药(54%)。
研究的主要终点是对心血管原因或任何原因死亡的至首次住院时间、至任何原因死亡时间、对心血管原因至首次住院时间、和至心血管死亡时间和还探讨了至所有死亡原因时间。
患者年龄范围从23至97岁;42%为75岁或以上。47%患者是女性和大多数是高加索人(89%)。纳入患者中约71%无心衰史。中位射血分数为60%。29%患者有心衰,大多数NYHA类别II(17%)。大多数有高血压(86%)和结构性心脏病(60%)。
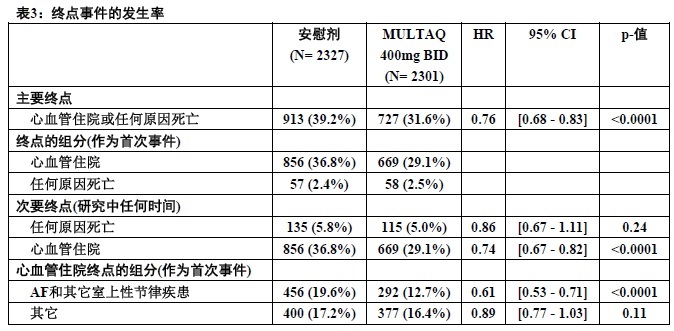
表3中显示结果。当与安慰剂比较时MULTAQ减低心血管住院或任何原因死亡的组合终点24.2%。这个差别是完全归因于其对心血管住院的效应,主要是与AF相关住院。
表3中显示其它终点,任何原因死亡和对心血管原因首次住院。次要终点计数某种特殊类型所有首次事件,它们是或不是在某种不同类型事件前。
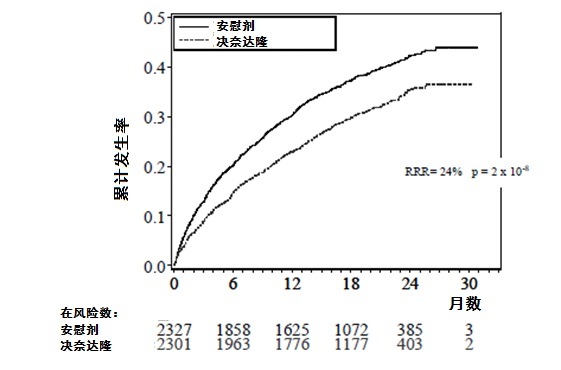
在图1中显示至首次事件时间的Kaplan-Meier累计发生率曲线。早期事件曲线分开和在随访30个月期间继续分离。

图2:按照被选择基线特征:首次心血管住院或任何原因死亡的相对风险(MULTAQ相比安慰剂)估算值与95%可信区间。
14.2 EURIDIS和ADONIS研究
在EURIDIS和ADONIS研究中,总共1237例窦性心律有既往AF或AFL发作的患者在门诊情况下被随机化和用或MULTAQ 400mg每天2次(n=828)或安慰剂(n=409)在常规治疗顶部治疗(包括口服抗凝剂、β-阻滞剂、ACE抑制剂或ARBs、慢性抗血小板药、利尿药、他汀类、地高辛、和钙通道阻滞剂)。患者至少有有1个ECG-记录AF/AFL发作纳入研究前3个月期间但是在窦性心律至少1个小时。患者年龄范围从20至88岁,大多数是高加索人(97%),男性(70%)患者。最常见同时患倍为高血压(56.8%)和结构性心脏病(41.5%),包括冠状动脉疾病(21.8%)。患者随访共12个月。从EURIDIS和ADONIS合并资料以及在个别试验中,决奈达隆延缓至AF/AFL首次复发时间(主要终点),在12个月研究期间减低首次AF/AFL复发时间约25%,在12个月时绝对复发率差别约11%。
14.3ANDROMEDA研究(在有严重心衰患者中增加死亡率)
最近住院有症状性心衰和严重左心室收缩功能不全(室壁运动指数1.2)患者被随机化至或每天2次MULTAQ 400mg或匹配的安慰剂,用一个对心衰所有致死亡或住院的主要组合终点。在纳入627/1000例计划患者后(决奈达隆和安慰剂组中分别为310例和317例),和随访中位时间63天,因为决奈达隆组过量的死亡率试验被终止。决奈达隆组25例患者(8.1%)相比安慰剂组12例患者(3.8%)死亡,危害比2.13;95%CI:1.07至4.25;p=0.027。死亡主要原因是心衰变坏。决奈达隆组中还有对心血管原因的过多住院(71例相比安慰剂51例)[见黑框警告和禁忌证(4)]。
ANDROMEDA和ATHENA研究中纳入人群明显不同。ANDROMEDA纳入患者有相对严重心衰和曾住院,或为心衰症状变坏,令人注目的气短去心衰专科诊所。注意这些在纳入时可能以被诊所改善而他们病史特点是失代偿。纳入ANDROMEDA患者主要是NYHA类别II(40%)和类别III(57%),和只有38%有AF/AFL史(在随机化时25%有AF)。相反,在ATHENA研究,71%患者没有心衰,25%是NYHA类别I或II,和只有4%是类别III。所有患者有AF/AFL史。

