批准日期:2016年12月19日;公司:Clovis Oncology,Inc.
治疗:卵巢癌
http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/209115s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用RUBRACA所需所有资料。请参阅RUBRACA完整处方资料。
RUBRACA™(rucaparib)片,为口服使用
美国初次批准:2016
适应证和用途
RUBRACA是一种聚(ADP-核糖)聚合酶(PARP)抑制剂适用为单药治疗晚期卵巢癌有害的BRCA突变(种系和/或体细胞)曽被两种或更多化疗治疗患者的治疗根据一个FDA批准对Rubraca的协同诊断为治疗选择患者。(1,2.1)
这个适应证是根据客观反应率和反应时间在加速批准下被批准的。继续批准这个适应证可能却决于在验证性试验中证实和临床获益的描述。(1,14)
剂量和给药方法
● 推荐剂量为600 mg口服每天2次有或无食物。(2.2)
● 继续治疗直至疾病进展或不可接受毒性。(2.2)
● 对不良反应,考虑治疗中断或减低剂量。(2.3)
剂型和规格
片:200 mg和300 mg(3)
禁忌证
无。(4)
警告和注意事项
● 骨髓增生异常综合征/急性髓性白血病(MDS/AML):
在暴露于RUBRACA患者发生MDS/AML,包括一个AML致命性事件。在基线时和其后每月监视患者血液学毒性。如被确证MDS/AML终止。(5.1)
● 胚胎-胎儿毒性:RUBRACA可能致胎儿伤害。劝告有生殖潜能女性对胎儿潜在风险和使用有效避孕。(5.2,8.1,8.3)
不良反应
● 最常见不良反应(≥ 20%)为恶心,疲乏(包括无力),呕吐,贫血,腹痛,味觉障碍,便秘,食欲减退,腹泻,血小板减少,和呼吸困难。(6.1)
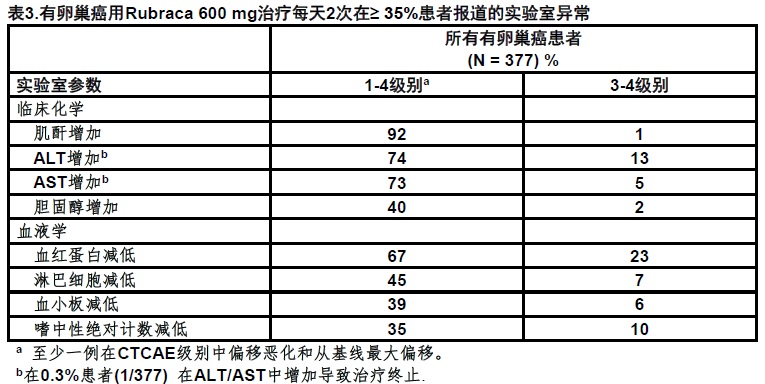
● 最常见实验室异常(≥ 35%)为肌酐增加, ALT增加,AST增加,血红蛋白减低,淋巴细胞减低,胆固醇增加,血小板减低,和嗜中性计数绝对值减低。(6.1)
报告怀疑不良反应,联系Clovis Oncology,Inc电话1-844-258-7662或FDA电话1-800-FDA-1088 or www.fda.gov/medwatch.
在特殊人群中使用
● 哺乳:建议妇女不要哺乳喂养。(8.2)
完整处方资料
1 适应证和用途
Rubraca™ 是适用为单药治疗为有害的BRCA突变 (种系和/或体细胞)伴晚期卵巢癌曽用两种或更多化疗治疗患者的治疗。根据一个FDA批准对Rubraca的协同诊断为治疗选择患者[见剂量和给药方法(2.1)]。
这个适应证是根据客观反应率和反应时间加速批准下被批准[见临床研究(14)]。继续批准这个适应证可能是取决于在验证性试验中临床获益的证实和描述。
2 剂量和给药方法
2.1 患者选择
选择患者用Rubraca对晚期卵巢癌的治疗根据 the presence of a 有害的BRCA突变(种系和/或体细胞)[见适应证和用途(1)和临床研究(14)]。对有卵巢癌患者中肿瘤BRCA突变检测FDA批准的测试资料在:http://www.fda.gov/CompanionDiagnostics.
2.2 推荐剂量
Rubraca的推荐剂量是600 mg(two 300 mg片)口服每天2次有或无食物。
继续治疗直至疾病进展或不可接受毒性。
如一例患者缺失一剂Rubraca,指导患者在时间表中下一次剂量。呕吐剂量不应被取代。
2.3 对不良反应剂量修饰
处置不良反应,考虑治疗中断或减低剂量。在表中指示推荐剂量减低。

3 剂型和规格
●片(200 mg):蓝色,圆形,立即释放,膜包衣,凹陷有“C2”。
●片(300 mg):黄色,椭圆形,立即释放,膜包衣,凹陷有“C3”。
4 禁忌证
无。
5 警告和注意事项
5.1 骨髓增生异常综合征/急性髓性白血病
在2/377(0.5%)有卵巢癌用Rubraca治疗患者报道骨髓增生异常综征(MDS)/急性髓性白血病(AML)。MDS/AML诊断前Rubraca治疗的时间分别是57天和539天。两种患者治疗前都接受以前用铂和其他DNA损伤药物。
此外,在有卵巢癌患者纳入一项盲态,随机化试验评价Rubraca 相比安慰剂报道2例(< 1%) AML。一例AML为致命性。AML的诊断前治疗时间为107天和427天。两例患者曽接受以前用铂和其他DNA损伤药物治疗。
在基线和其后每月监视完全血计数测试。在患者没有从以前化疗(≤1级)所致血液学毒性恢复前不要开始Rubraca。对延长血液学毒性,中断Rubraca和每周监视血细胞计数直至恢复。如水平至1级或低于4周后,将患者转诊给血液学家进一步调查,包括骨髓分析和血样品为细胞遗传学。如MDS/AML被确证,终止Rubraca。
5.2 胚胎-胎儿毒性
当给予Rubraca妊娠妇女根据其作用机制和动物研究发现可能致胎儿伤害。在一项动物生殖研究,在器官形成期给予rucaparib至妊娠大鼠导致胚胎-胎儿死亡在母体暴露为接受推荐剂量600 mg每天2次患者AUC为0.04倍。通知妊娠妇女对胎儿潜在风险。建议有生殖潜能妇女在治疗期间和末次Rubraca剂量后共6个月服用有效避孕[见在特殊人群中使用(8.1,8.3)和临床药理学(12.1)]。
6 不良反应
在说明书其他处讨论以下严重的不良反应:
● 骨髓增生异常综合征/急性髓性白血病[见警告和注意事项(5.1)]。
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在两项开放,单臂试验在377例有卵巢癌被治疗患者中曽研究Rubraca 600 mg每天2次作为单药治疗。在这些患者中,中位年龄为62岁(范围31至86),100%有东部肿瘤协作组(ECOG) 体能状态0或1,38%有BRCA突变的卵巢癌,45%曽接受3或更多以前化疗线,和自卵巢癌诊断中位时间为43个月(范围6至197)。
在62%患者不良反应导致剂量减低或中断,最频来自贫血(27%),和疲乏/无力(22%)。不良反应导致剂量终止在10%患者,最频繁来自疲乏/无力(2%)。治疗的中位时间为5.5 个月(范围0.1 至28.0)。
表2和表3分别总结用Rubraca治疗患者中观察到常见不良反应和异常实验室发现。
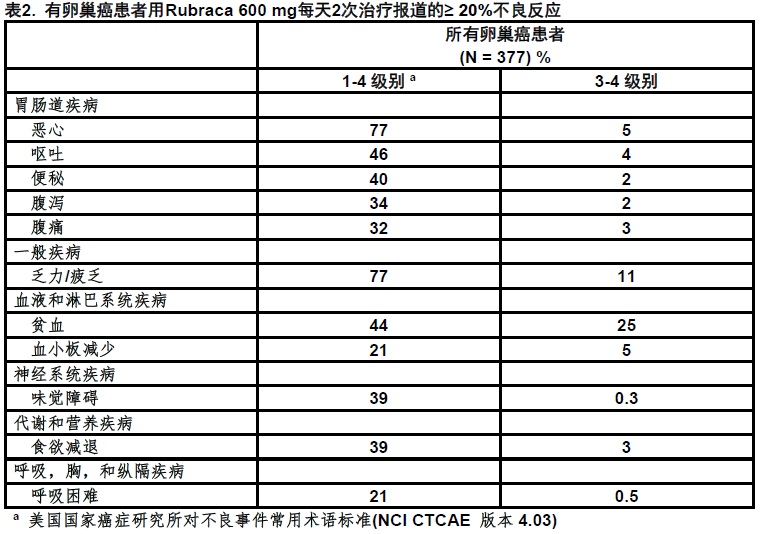
在用Rubraca 600 mg每天2次治疗曽被鉴定377例患者< 20%的以下不良反应:眩晕(17%),嗜中性粒细胞减少(15%),皮疹(包括皮疹,红斑疹,斑丘疹和皮炎)(13%),发热(11%),光敏性反应(10%),瘙痒(包括瘙痒和全身瘙痒)(9%),手足肌红斑综合征[Palmarplantar erythrodysaesthesia syndrome](2%),和发热性嗜中性粒细胞减少(1%)。
8 在特殊人群中使用
8.1 妊娠
风险总结
根据动物研究发现及其作用机制,当给予妊娠妇女Rubraca可能致胎儿伤害。没有在妊娠妇女可得到的数据告知药物关联风险。在一项动物生殖研究中,在器官形成期给予rucaparib至妊娠大鼠在母体暴露是在患者接受推荐剂量600 mg每天2次AUC0-24h为0.04倍时导致胚胎-胎儿死亡[见数据]。
通知妊娠妇女对胎儿潜在风险。
不知道在适应证人群中重大出生缺陷和流产的背景风险。在美国一般人群中,重大出生缺陷和在临床上认可妊娠的估算背景风险分别为2%至4%和15%至20%。
数据
动物数据
在一项剂量范围-发现胚胎-胎儿发育研究中,妊娠大鼠在器官形成阶段期间接受口服剂量50,150,500,或1000 mg/kg/day的rucaparib。观察到在所有剂量大于或等于50 mg/kg/day(根据AUC0-24h母体全身暴露约人在推荐剂量暴露的0.04倍)观察到有植入后丢失(100%早期再吸收)。
8.2 哺乳
风险总结
没有关于在人乳汁中的存在,或关于它对乳汁产生或哺乳喂养婴儿的影响的资料。因为在哺乳喂养婴儿中来自严重的不良反应的潜能,建议哺乳妇女在用Rubraca治疗期间和最后剂量后共2周不要哺乳喂养。
8.3 生殖潜能的女性和男性
妊娠测试
建议对生殖潜能女性开始Rubraca前进行妊娠测试。
避孕
女性
当Rubraca给予一位妊娠妇女可能致胎儿伤害[见在特殊人群中使用(8.1)]。建议有生殖潜能女性在治疗期间和Rubraca的最后剂量后共6个月使用有效避孕。
8.4 儿童中使用
尚未确定Rubraca在儿童患者的安全性和有效性。
8.5 老年人使用
Rubraca临床试验中377例卵巢癌患者160例(42%)为65岁或以上。这些患者和较年轻患者间未观察到在安全性总体差别,但不能除外有些较老年个体更大敏感性。由于小数量患者(N=38)不能评估在有BRCA-突变体卵巢癌年龄65岁或以上患者中Rubraca的有效性。
8.6 肝受损
对患者有轻度肝受损没有起始剂量调整的建议(总胆红素低于或等于正常上限[ULN]和AST大于ULN,或总胆红素1.0至1.5倍ULN间和任何AST)。对有中度至严重肝受损患者(总胆红素大于1.5倍ULN)由于缺乏数据 不能得到起始剂量调整的建议[见临床药理学(12.3)]。
8.7 肾受损
对有轻度至中度肾受损患者没有推荐的起始剂量(肌酐清除率[CLcr] 30和89 mL/min间,当用Cockcroft-Gault方法估算)。对患者有CLcr低于30 mL/min或对透析患者由于缺乏数据没有推荐度起始剂量[见临床药理学(12.3)]。
10 药物过量
Rubraca过量事件中没有特异性处理,和没有确定过量的症状。在过量事件中,医生应遵循一般支持措施和应对症地治疗。
11 一般描述
Rucaparib是一种哺乳动物聚腺苷5’-二磷酸核糖聚合酶(PARP)酶的抑制剂。化学名是8-fluoro-2-{4-[(methylamino)methyl]phenyl}-1,3,4,5-tetrahydro-6H-azepino[5,4,3-cd]indol-6-one((1S,4R)-7,7-dimethyl-2-oxobicyclo[2.2.1]hept-1-yl)methane磺酸盐。Rucaparib右旋樟脑磺酸盐的化学式是C19H18FN3O•C10H16O4S和相对分子质量为555.67 道尔顿。
下面显示右旋樟脑磺酸盐的结构:
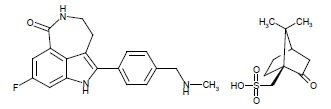
Rucaparib右旋樟脑磺酸盐是一个白色至淡黄色粉;制剂为一个片为口服使用。跨越生理学pH范围Rucaparib显示约1 mg/mL与pH无关低溶解度。
Rubraca(rucaparib)片含rucaparib右旋樟脑磺酸盐作为活性成分。每200 mg片含344 mg rucaparib右旋樟脑磺酸盐等同于200 mg rucaparib游离碱。每300 mg片含516 mg rucaparib 右旋樟脑磺酸盐等同于300 mg rucaparib游离碱。
在Rubraca片中无活性成分包括:微晶纤维素,淀粉羟乙酸钠,胶体二氧化硅,和硬脂酸镁。 对200 mg片化妆品蓝膜涂层和对300 mg片化妆品黄膜涂层是Opadry II含聚乙烯醇,二氧化钛,聚乙二醇/聚乙二醇[macrogol],和滑石。涂层着色为蓝色用亮蓝铝色淀和靛蓝胭脂红铝湖,或黄色用黄色氧化铁。
12 临床药理学
12.1 作用机制
Rucaparib是聚(ADP-核糖)聚合酶(PARP)酶一个的抑制剂,包括PARP-1,PARP-2,和PARP-3,它们在DNA修复中起作用。体外研究曽显示rucaparib-诱导细胞毒性可能涉及PARP酶学活性的抑制作用和增加PARP-DNA复合物的形成导致DNA损伤,凋亡,和细胞死亡。观察到在BRCA1/2和其他DNA修复基因有缺陷肿瘤细胞系增加rucaparib-优点的细胞毒性。Rucaparib在BRCA中有或无缺陷的人癌症的小鼠异种移植模型中曽被显示减低肿瘤生长。
12.2 药效动力学
曽未确定rucaparib的药效动力学特征。
心脏电生理学
在一项开放单-臂研究在56例有实体瘤患者正在被给予连续剂量的Rubraca范围从40 mg每天1次(批准的推荐剂量的0.03倍)至840 mg每天2次(批准的推荐剂量的1.4倍)评价Rubraca多次给药对QTc间期的影响。在稳态的600 mg rucaparib每天2次均数QTcF从基线增加(在群体药代动力学估算的95%百分位数Cmax(3019 ng/mL 90%可信区间[CI])时)为14.9 msec(11.1-18.7 msec)。
12.3 药代动力学
Rucaparib的所有药代动力学是在有癌症患者确定其特征。跨越一个剂量范围从240至840 mg每天2次Rucaparib显示线性药代动力学与时间独立性和剂量正比例性。.
在被批准的推荐剂量Rucaparib 的均数稳态Cmax为1940 ng/mL(变异系数54%[CV])和AUC0-12h为16900 h⋅ng/mL(54% CV)。积蓄为3.5至6.2倍。单次静脉剂量12至40 mg rucaparib后中位末端半衰期(T1/2)为17小时。
吸收
在批准的推荐剂量时中位Tmax为1.9小时。Rucaparib立即释放片的均数绝对生物利用度为36%与一个范围从30%至45%。
高-脂肪餐后,与空腹条件给药比较时Cmax增加20%和AUC0-24h增加38%,和Tmax被延迟2.5小时[见剂量和给药方法(2.2)]。
分布
在单次静脉剂量12 mg至40 mg rucaparib后,Rucaparib有一个稳态分布容积113 L至262 L。
在体外,在人血浆中在治疗浓度时rucaparib的蛋白结合是70%。Rucaparib优先地分布至红细胞有一个血液-与-血浆浓度比值1.83。
消除
单次口服剂量600 mg rucaparib后,Rucaparib的均数末端T1/2为17至19小时。连续600 mg rucaparib口服每天2次后,表观清除率范围从15.3至79.2 L/hour。单次静脉剂量rucaparib 12 mg至40 mg后,清除率范围从13.9至18.4 L/hour。
代谢
在体外,rucaparib是主要地被CYP2D6代谢和被CYP1A2和CYP3A4较低程度。
特殊人群
年龄,种族,和体重
根据群体药代动力学分析,年龄,种族,和体重对rucaparib暴露没有临床意义的影响。
肾受损
在接受Rubraca 600 mg每天2次患者,有轻度肾受损患者(N=148;CLcr 60和89 mL/min间,当通过Cockcroft-Gault法估算时)和有中度肾受损(N=72;CLcr 30和59 mL/min间) 与患者有正常肾功能(N=143;CLcr大于或等于90 mL/min) 比较 显示分别约15%和32%较高的稳态AUC。不知道在患者有CLcr低于30 mL/min或用透析患者rucaparib药代动力学特征。
肝受损
根据群体药代动力学 分析,在34例有轻度肝受损患者(总胆红素低于或等于ULN和AST大于ULN,或总胆红素1.0至1.5倍ULN间和任何AST)患者接受Rubraca 600 mg每天2次当与有正常肝功能(N=337) 患者比较未观察到明显药代动力学差别。不知道在有中度至严重肝受损患者(总胆红素大于ULN的1.5倍) rucaparib的药代动力学特征。
CYP酶多态性
根据群体药代动力学分析,跨越CYP2D6或CYP1A2基因型亚组rucaparib 600 mg每天2次后稳态浓度没有显著不同。
药物相互作用研究
其他药物对Rucaparib的影响
在体外,rucaparib有一个低代谢更新率在人肝微粒体中,和主要地被CYP2D6代谢和被CYP1A2和CYP3A4至较低程度。在体外,rucaparib被显示是P-gp和BCRP的底物,但不是肾摄取转运蛋白OAT1,OAT3,和OCT2,或肝转运蛋白OATP1B1和 OATP1B3的底物。.
与质子泵抑制剂同时治疗在稳态暴露无临床上意义变化。
Rucaparib对其他药物的影响
尚未在人中研究rucaparib对其他药物的影响。Rucaparib可逆地抑制CYP1A2,CYP2C19,CYP2C9,和CYP3A,和对CYP2C8,CYP2D6,和UGT1A1至一个较低程度。Rucaparib在人肝细胞中在临床相关暴露诱导CYP1A2,和下调CYP2B6和CYP3A4。Rucaparib是MATE1和MATE2-K一个强抑制剂,和OCT1的一个中度抑制剂。在超-治疗浓度(300 μM)的观察到rucaparib对MRP4,OATP1B1,OATP1B3,OAT1,和OAT3弱抑制作用。对MRP2,MRP3,或BSEP未观察到抑制作用。Rucaparib是BCRP和P-gp外排性转运蛋白抑制剂有IC50分别为55 μM和283 μM。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
尚未用rucaparib进行致癌性研究。
Rucaparib是致遗传性在细菌回复突变(Ames)测试,和在一项培养人淋巴细胞体外染色体畸变试验致畸变性。根据rucaparib的作用机制预计在有丝分裂刺激的细胞中致畸变反应和表明在人中遗传毒性的潜能。
尚未用rucaparib进行生育力研究。在3-个月重复-给药毒理学研究中,在大鼠和犬中在剂量分别至100 mg/kg/day和20 mg/kg/day,rucaparib对对雄性和雌性生殖器官无影响。这些剂量水平导致在推荐剂量全身暴露分别约人暴露(AUC0-24h)0.3和0.09倍。
14 临床研究
在两项多中心,单臂,开放临床试验,研究1和研究2,在106例患者在2或更多以前化疗后已进展有晚期BRCA-突变体卵巢癌患者研究Rubraca的疗效。所有106例患者接受Rubraca 600 mg口服每天2次作为单药治疗直至疾病进展或不可接受的毒性。通过研究者和独立放射学审
患者的中位年龄为59岁(范围33至84),多数为高加索人(78%),和100%有一个东方合作肿瘤学组(ECOG)性能状态0或1。所有患者曽接受至少两个基于铂化疗和43%曽接受3或更多以前化疗线。有18/106(17%)患者在肿瘤中曽有被检测到的有害BRCA突变和不是全血标本。在96%(64/67)患者可得到通过协同诊断FoundationFocus CDxBRCA™测试肿瘤组织样品患者,它被FDA批准为选择为Rubraca治疗选择患者。肿瘤BRCA突变状态被回顾地证实。
在表4中总结疗效结果。
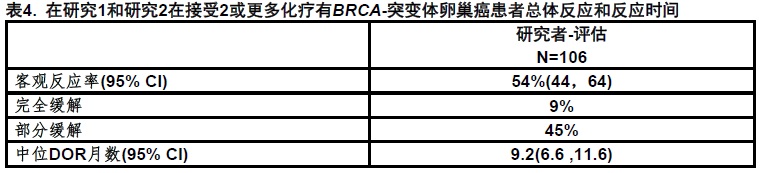
由独立放射学审评的反应评估是42%(95% CI [32,52]),与一个中位DOR为6.7个月(95% CI [5.5,11.1])。研究者-评估ORR在铂-敏感患者为66%(52/79;95% CI [54,76]),在铂-抗性患者为25%(5/20;95% CI [9,49]),和在铂-难治患者中为0%(0/7;95% CI [0,41])。对有一个BRCA1基因突变或BRCA2基因突变患者ORR为相似。
16 如何供应/贮存和处置
16.1 如何供应
Rubraca是可得到为200 mg和300 mg片。
200 mg片:
● 蓝色,圆形,和在一侧凹陷有“C2”
● 在60片瓶中供应(NDC:69660-201-91)
300 mg片:
● 黄色,椭圆形,和一侧凹陷有“C3”
● 在60片瓶中供应(NDC:69660-203-91)
16.2 贮存
贮存在20°C至25°C(68°F至77°F);外出允许至15°C至30°C(59°F至86°F)[见USP控制室温]。
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(患者资料)。
MDS/AML:如他们经受软弱,感觉疲乏,发热,体重减轻,频繁感染,瘀伤,容易出血,气喘,尿或粪中血,和/或实验室发现血细胞计数低,或需要血液输注,建议患者联系他们的卫生保健提供者。这些可能是血液学毒性的征象或一个更严重的不常见骨髓问题被称为‘骨髓增生异常综合征’(MDS)或‘急性髓性白血病’(AML)在用Rubraca治疗患者中曽报道它[见警告和注意事项(5.1)]。
胚胎-胎儿毒性:建议女性告知她们的卫生保健提供者如她们是妊娠或成为妊娠。
告知女性患者对一个胎儿的风险和丧失妊娠的潜在可能[见在特殊人群中使用(8.1)]。
建议有生育潜能女性在治疗期间和接受末次剂量Rubraca后共6个月使用有效避孕[见警告和注意事项(5.2)和在特殊人群中使用(8.1,8.3)]。
光敏感性:建议患者使用适当的阳光保护由于当服用Rubraca增加对日晒伤的敏感性[见不良药物反应(6.1)].
哺乳:建议女性在治疗期间和末次剂量Rubraca后共2周不要哺乳喂养[见在特殊人群中使用(8.2)]。
给药指导:指导患者服用Rubraca口服每天2次有或无食物。给药间隔应约12小时。建议患者 如缺失一剂Rubraca或患者在服用一剂Rubraca后呕吐,患者不应服用额外剂量,但在常规时间的下一剂量[见剂量和给药方法(2.1)]。

