批准日期: 2015年7月10日;公司:大冢制药有限公司和H. Lundbeck A/S
美国FDA批准新药治疗精神分裂症和作为一种添加至一种抗抑郁剂治疗重性抑郁症
FDA的药品评价和研究中心精神产品部门主任说:“精神分裂症和重性抑郁症可以能致残和可能大大地破坏天-天活动,”“药物对每个人影响不同所以重要的是对精神疾病患者可得到各种各样治疗选择。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/205422s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用REXULTI®所需所有资料。请参阅REXULTI完整处方资料。
REXULTI®(brexpiprazole)片,为口服使用
美国初次批准:2015

适应证和用途
REXULTI 是一种非典型的抗精神病药 适用为:
⑴ 用作一种辅助治疗对抗抑郁药为重性抑郁症(MDD的治疗(1,14.1)
⑵ 精神分裂症的治疗(1,14.2)
剂量和给药方法
有或无食物给予REXULTI 每天1次。(2.1,2.2,12.3)

中度至严重 肝受损(Child-Pugh评分 ≥7):对有MDD患者最大推荐剂量是2 mg每天1次和对有精神分裂症患者3 mg每天1次(2.3)
中度,严重或肾受损终末期(CLcr<60 mL /minute):对有MDD患者最大推荐剂量是2 mg每天1次和对有精神分裂症患者3 mg每天1次(2.4)
已知的CYP2D6弱代谢者:减低寻常剂量至一半(2.5)
剂型和规格
片:0.25 mg,0.5 mg,1 mg,2 mg,3 mg,,和4 mg(3)
禁忌证
已知对REXULTI或其任何组分超敏性(4)
警告和注意事项
⑴在老年患者与老年痴呆症有关的精神病脑血管不良反应:脑血管不良反应发生率增加(如 卒中,短暂性缺血发作)(5.3)
神经阻滞剂恶性综合征:用立即终止和密切监视处置(5.4)
迟发性运动障碍:终止如临床上适当(5.5)
代谢变化:监视高血糖/糖尿病,血脂异常和体重增加(5.6)
白细胞减少,中性粒细胞减少,和粒细胞减少症:在有预先存在低白细胞计数(WBC)或白细胞减少或中性粒细胞减少病史患者进行完全血细胞计数(CBC)。如发生一个临床上意义WBC降低缺乏其他致病因子时,考虑终止REXULTI(5.7)
体位性低血压和昏厥:监视心率和血压和警告有已知心血管或脑血管病患者,和 脱水或昏厥的风险(5.8)
癫痫发作:在癫痫发作病史患者或有降低癫痫发作阈值的情况谨慎使用(5.9)
不良反应
最常见不良反应是(6.1):
MDD:体重增加和静坐不能(≥5%和至少对安慰剂率的2倍)
精神分裂症:体重增加(≥4%和至少对安慰剂率的2倍)
报告怀疑不良反应,联系Otsuka美国制药电话1-800-438-9927或FDA电话1-800-FDA-1088(www.fda.gov/medwatch).
药物相互作用
在特殊人群中使用
妊娠:在妊娠第三个三个月暴露新生儿中可能致锥体外系和/或戒断症状(8.1)
完整处方资料

1 适应证和用途
REXULTI是适用为:
● 重性抑郁症(MDD)的辅助治疗[见临床研究(14.1)]。
● 精神分裂症的治疗[见临床研究(14.2)]。
2 剂量和给药方法
2.1重性抑郁症辅助治疗
对REXULTI作为辅助治疗的推荐起始剂量是0.5 mg或1 mg每天1次,有或无食物经口服用[见临床药理学(12.3)].
滴定调整至1 mg 每天1次,然后至目标剂量2 mg每天1次。剂量增加应发生在每周间隔根据患者的临床反应和耐受性。每天最大推荐剂量是3 mg。定期地再评估以确定继续需要和对治疗适当剂量。
2.2 精神分裂症的治疗
对REXULTI的推荐起始剂量是在第1至第4天1 mg每天1次,有或无食物口服[见临床药理学(12.3)]。
推荐的目标REXULTI剂量是2 mg至4 mg每天1次。在第5至第5天滴定调整至2 mg 每天1次,然后根据患者的临床反应和耐受性在第8天至4 mg。每天最大推荐剂量是4 mg。定期地再评估以确定继续的需要和对治疗的适当剂量。
2.3 对肝受损剂量调整
对有中度至严重肝受损患者(Child-Pugh评分 ≥7),对有MDD患者最大推荐剂量是2 mg每天1次,和对有精神分裂症患者3 mg每天1次[见在特殊人群中使用(8.7),临床药理学(12.3)]。
2.4 对肾受损剂量调整
对有中度,严重或终末期肾受损患者(肌酐清除率CLcr<60 mL/minute),对有MDD患者最大推荐剂量是2 mg每天1次和对有精神分裂症患者3 mg每天1次[见在特殊人群中使用(8.8),临床药理学(12.3)]。
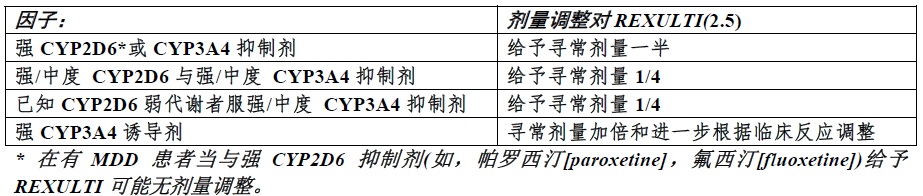
2.5对CYP2D6弱代谢者和对与CYP抑制剂或诱导剂同时使用剂量调整
已知细胞色素P450(CYP)2D6弱代谢者患者和患者同时服用C被终止,调整REXULTI剂量至其原始水平。如共同给药CYP3A4诱导剂被终止,减低REXULTI剂量至原始水平跨越 1至2 周[见药物相互作用(7.1),临床药理学(12.3)]。
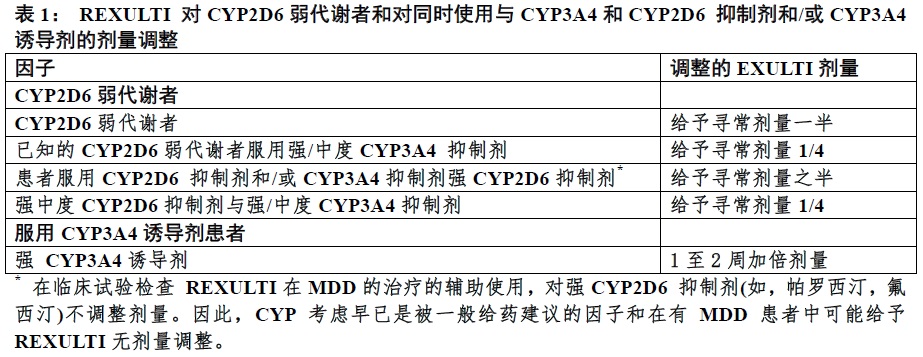
3 剂型和规格
可得到6种强度规格的REXULTI片(见表2)。
4 禁忌证
在有已知对REXULTI或其任何组分超敏性患者禁忌REXULTI。反应曾包括皮疹,面肿胀,荨麻疹,和过敏反应。
5 警告和注意事项
5.1 在老年患者有痴呆相关中增加死亡率
老年患者与老年痴呆症有关的精神病用抗精神病药治疗是处于增加死亡的风险。17项安慰剂-对照试验的分析(10周的模式时间),大多数患者服用非典型的抗精神病药,揭示在安慰剂-治疗患者一个死亡的风险在药物-治疗患者1.6至1.7倍间的死亡风险。跨越一个典型的10-周对照试验疗程,在药物-治疗患者中的死亡率是约4.5%,与之比较安慰剂组中发生率约2.6%。
虽然死亡的原因是变化的,死亡的大多数性质将或心血管(如,心力衰竭,突然死亡)或感染(如,肺炎)。
观察性研究提示,与非典型的抗精神病药相似,治疗用常规抗精神病药可能增加死亡率。在观察性研究中增加死亡率发现的程度可能归咎于抗精神病药而相反患者有些特征不清楚。REXULTI没有被批准为与老年痴呆症有关的精神病患者的治疗[见黑框警告,警告和注意事项(5.3)]。
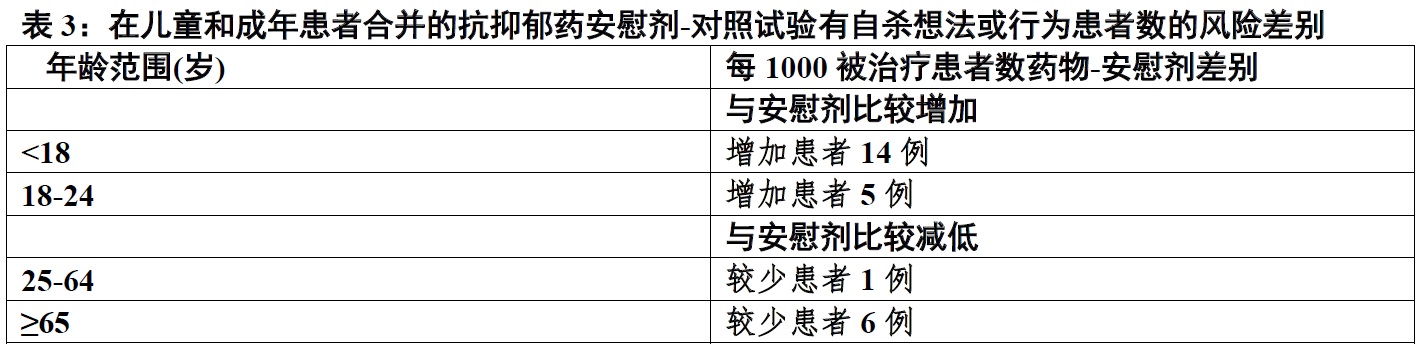
5.2 在儿童,青少年和年轻成年中自杀想法和行为
在抗抑郁剂(SSRIs和其他抗抑郁剂类别)安慰剂-对照试验合并的分析包括约例77,000成年患者,和超过4,400例儿童患者,在年龄24 岁和以下患者在抗抑郁剂-治疗患者比安慰剂-治疗患者自杀想法和行为的发生率更大。表3中提供药物-安慰剂每1000被治疗患者自杀想法和行为病例数差别。
在任何儿童研究中无自杀发生。在成年研究中有自杀,但数量不够充分不足以得到关于抗抑郁剂药影响自杀的结论。
不知道在儿童,青少年,和成年中自杀想法和行为的风险是否延伸至较长期使用,即超过四个月。但是,来自安慰剂-对照维持研究在有MDD成年的实质性证据抗抑郁药延迟抑郁的再发生。
监视所有抗抑郁药治疗患者对临床自杀想法和行为的恶化和出现,尤其是药物治疗的初始几个月期间和在剂量变化时。与患者家庭成员或护理人员商讨以监视对行为变化和以警戒卫生保健提供者。在抑郁是持续地变坏,或正在经历出现自杀想法或行为患者,考虑改变治疗方案,包括终止REXULTI的可能性。
5.3 脑血管不良反应包括卒中在老年患者与老年痴呆症有关的精神病
在有痴呆老年患者中用利培酮[risperidone], 阿立哌唑[aripiprazole], 和奥氮平[olanzapine]安慰剂对照试验中与安慰剂-治疗受试者比较心血管不良反应的发生率较高(脑血管意外和短暂性缺血性发作),包括致死率。REXULTI没有被批准为治疗与老年痴呆症有关的精神病患者[见黑框警告,警告和注意事项(5.1)]。
5.4 神经阻滞剂恶性综合征(NMS)
伴随给予抗精神病药曾报道一种潜在致命性症状复合有时被称为神经阻滞剂恶性综合征(NMS)。
NMS的临床表现是高热,肌强直,改变的精神状态和自律神经失调的证据(不规则脉搏或血压,心动过速, 发汗和心律失常)。另外体征可能包括升高的肌酐激酶,肌红蛋白尿(横纹肌溶解症),和急性肾衰。
这个综合证患的诊断评价是复杂的。得出诊断,重要是排除病例其临床表现包括两方面严重内科疾病(如,肺炎,全身性感染,等)和未治疗或治疗不当的锥体外系体征和症状(EPS)。鉴别诊断中重要考虑包括中枢抗胆碱能毒性,热卒中,药物发热,和原发性中枢神经系统病变。
NMS的处理应包括:1) 立即终止对当前治疗不重要的抗精神病药和其他药物;2)强化对症治疗和医学监视;和3) 对可得到的特殊治疗任何同时治疗的严重医学问题。关于对NMS特殊的药理学治疗方案没有普遍协议。
如一例患者从NMS恢复后需要抗精神病药治疗,应仔细考虑再次引入药物治疗的潜在可能。 患者应被仔细地监视,因为曾报道NMS的复发。
5.5迟发性运动障碍[Tardive Dyskinesia]
在用抗精神病药治疗患者中可能发生一种潜在地不可逆的,不自主的,运动障碍运动综合证。虽然综合证的患病率似乎是在老年,尤其是老年妇女中最高,不可能在抗精神病药物治疗的开始依靠患病率估计预测,哪个患者可能发生此综合证。不知道抗精神病药引起迟发性运动障碍潜能是否不同。
发生迟发性运动障碍的风险和它可能将变成不可逆被认为增加治疗时间和给予患者抗精神病药累计总剂量增加。但是,综合证可能发展,虽然更不用说常见,在低剂量相对地简单治疗阶段后或可能甚至治疗终止后发生。
对迟发性运动障碍的已确定病例没有已知的治疗,虽然如抗精神病药治疗被撤去综合证可能部分地或完全地免除。
但是,抗精神病药治疗,本身,可能抑制(或部分地抑制)综合证的体征和症状和从而有可能掩盖了潜在的过程。
症状性抑制作用对综合证的长期过程影响不清楚。
鉴于这些考虑,REXULTI应以最可能缩小迟发性运动障碍的发生方式开处方。慢性抗精神病药治疗应一般地保留给予患有慢性疾病患者(1) 是已知对抗精神病药有反应,和(2)对不能得到或适宜另一种,等同疗效,但潜在地危害较低治疗。在患者 的确需要慢性治疗,应寻求最小剂量和最短治疗时间产生一个满意的临床反应。应定期地再次评估继续治疗的需求。
如患者用REXULTI出现迟发性运动障碍体征和症状,应被考虑药物终止。但是,有些患者可能需要用REXULTI治疗尽管存在该综合证。
5.6 代谢变化
非典型的抗精神病药曾伴随有代谢变化包括高血糖/糖尿病,血脂异常,和身体体重增加。而在这类中所有药物曾被显示产生有些代谢变化,每个药物有其自身特殊的风险图谱。
高血糖和糖尿病
用非典型的抗精神病药治疗患者中曾报道高血糖,在有些病例极和伴随酮症酸中毒或高渗性昏迷或死亡。用REXULTI治疗患者曾有高血糖报道[见不良反应(6.1)]。非典型的抗精神病药使用和葡萄糖异常间相互关系的评估通过有精神分裂症患者糖尿病的背景风险增加的可能性和在一般人群糖尿病发生率增加是复杂的。鉴于这些混杂非典型的抗精神病药使用和高血糖-相关不良反应间相互关系没有完全了解。但是,流行病学研究提示在用非典型的抗精神病药治疗患者中高血糖-相关不良反应风险增加。
已建立诊断糖尿病患者开始用非典型的抗精神病药应被规则地监视葡萄糖控制恶化。有对糖尿病风险因子患者(如,肥胖,糖尿病家族史正在开始用非典型的抗精神病药治疗治疗开始时和治疗期间定期地应进行空腹血葡萄糖测试。用非典型的抗精神病药治疗的任何患者应监视高血糖症状包括烦渴,尿频,多食,和虚弱。用非典型的抗精神病药治疗期间发生高血糖症状患者应进行空腹葡萄糖测试。在有些病例中,当非典型的抗精神病药被终止高血糖已解决;但是,有些患者需要继续抗糖尿病治疗尽管非典型的抗精神病药终止。
重性抑郁症
在6-周,安慰剂-对照,固定-剂量临床试验中有MDD患者,用REXULTI和安慰剂治疗患者口服血糖从正常(<100 mg/dL)转至高(≥126 mg/dL)和边缘(≥100和<126 mg/dL)至高患者的比例 相似。
在长期,开放抑郁研究,有正常基线空腹血糖5%的患者经历转移至高而服用REXULTI+抗抑郁剂(ADT);有边缘空腹血糖25%受试者经历转移至高。结合在一起,在长期抑郁研究期间有正常或边缘空腹血糖9%受试者经历转移至高空腹血糖。
精神分裂症
在6-周,安慰剂-对照,固定-剂量临床试验中在有精神分裂症患者,用REXULTI和安慰剂治疗患者中空腹血糖从正常(<100 mg/dL)至高(≥126 mg/dL)或边缘(≥100和<126 mg/dL)至高患者的比例相似。
在长期,开放精神分裂症研究,有正常基线空腹血糖8%患者经历当服用REXULTI 经历从正常转移至高,有边缘空腹血糖 17%受试者经历从边缘至高。结合一起,长期精神分裂症研究期间有正常或边缘10%受试者经历空腹血糖转移至高。
血脂异常
用非典型的抗精神病药治疗患者中曾观察到脂质不良改变。
重性抑郁症
在6-周,安慰剂-对照,固定-剂量临床试验在有MDD患者中,REXULTI-和安慰剂-治疗患者在空腹总胆固醇,LDL胆固醇,和HDL胆固醇变化相似。表4显示有空腹甘油三脂变化患者的比例。
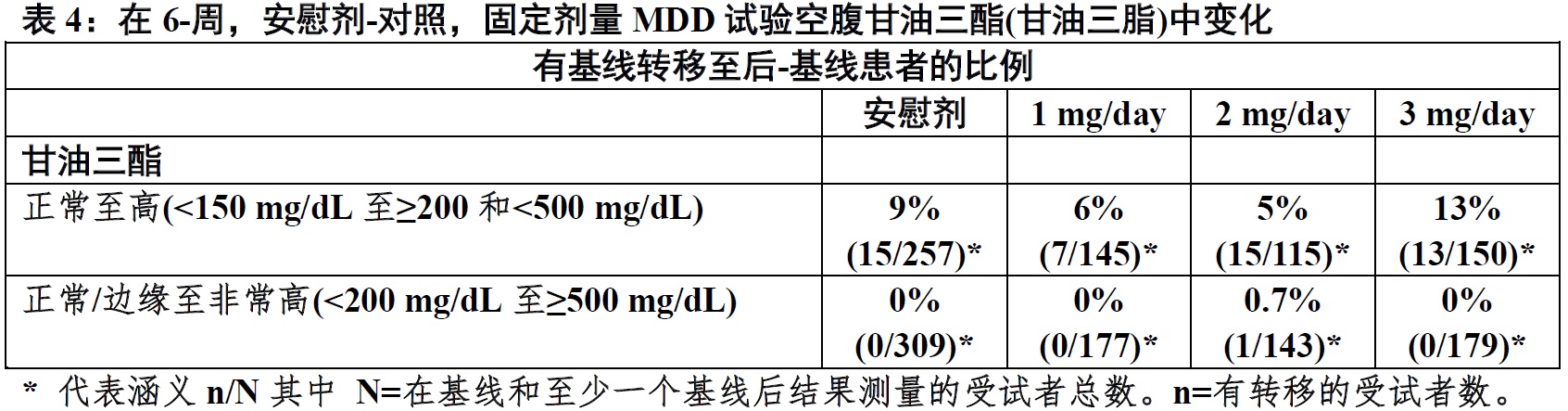
在长期,开放抑郁研究,服用 REXULTI患者基线空腹胆固醇从正常转移至高被报道9%(总胆固醇),3%(LDL胆固醇),和14%(HDL胆固醇)。有正常基线甘油三脂患者中,17%经历转至高,和0.2%经历转至非常高。结合在一起,长期抑郁研究期间of有正常或边缘空腹甘油三酯受试者0.6%经历转至非常高空腹甘油三酯。
精神分裂症
在有精神分裂症患者中6-周,安慰剂-对照,固定-剂量临床试验,在REXULTI-和安慰剂-治疗患者空腹总胆固醇,LDL胆固醇,和HDL胆固醇变化相似。表5显示有空腹甘油三脂变化患者的比例。
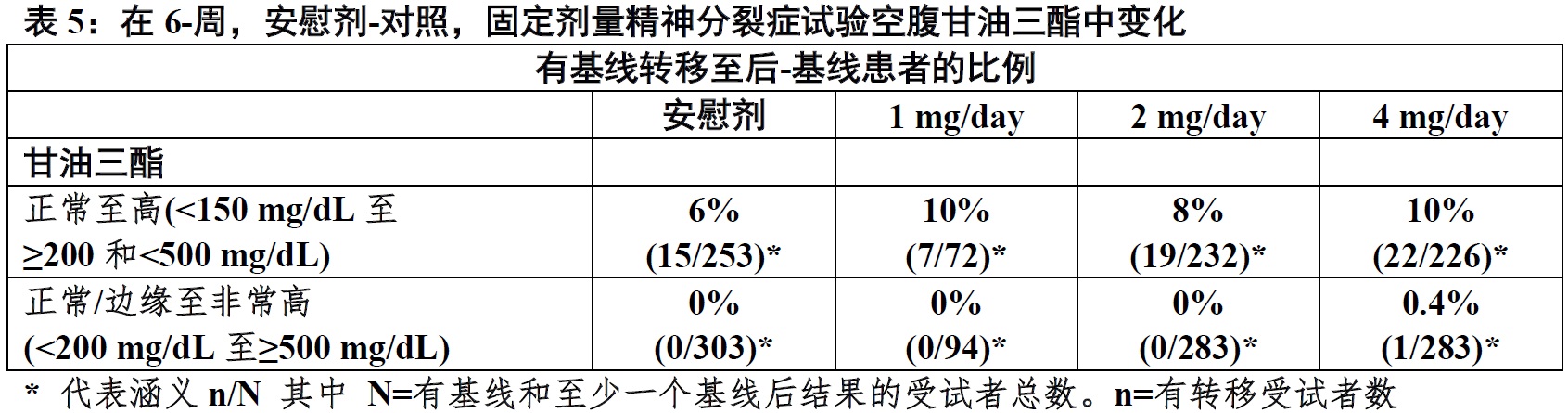
在长期,开放精神分裂症研究中,服用 REXULTI患者基线空腹胆固醇从正常转至高被报道6%(总胆固醇),2%(LDL胆固醇),和17%(HDL胆固醇)。有正常基线甘油三脂患者中,13% 经历转至高,和0.4%经历转至非常高甘油三脂。结合在一起,长期精神分裂症研究期间, of有正常或边缘空腹甘油三酯受试者0.6%经历转至非常高空腹甘油三酯。
体重增加
在用非典型的抗精神病药治疗患者中曾观察到体重增加。建议临床监视体重。
重性抑郁症
表6显示在末次访问时体重增量数据和从有MDD患者6-周,安慰剂-对照,固定-剂量临床研究终点时体重增加≥7%成年患者的百分比。 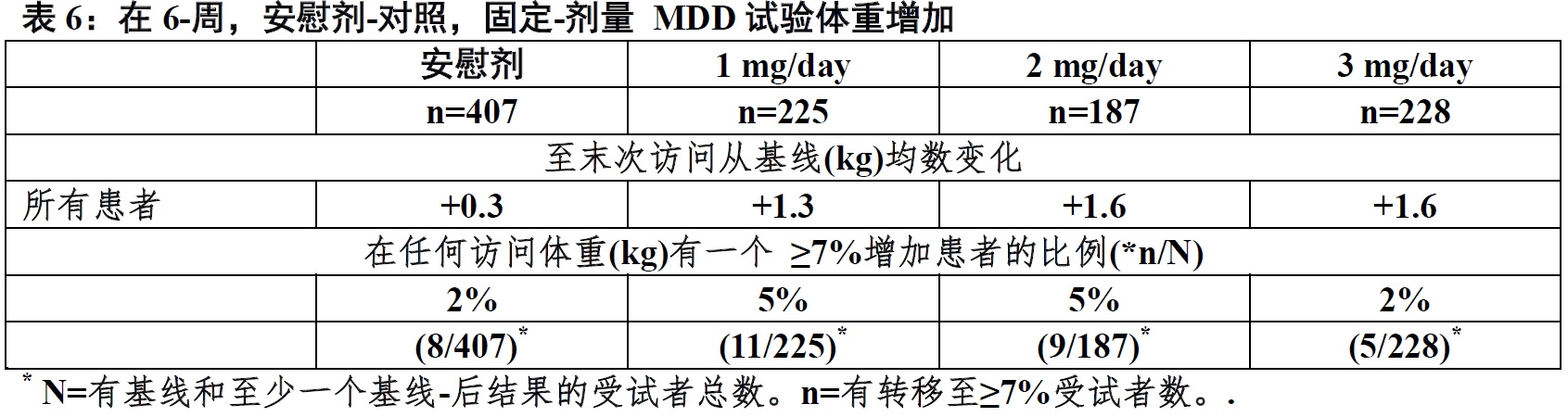
精神分裂症
表7 显示在末次访问体重增加数据和从有精神分裂症患者6-周,安慰剂-对照,固定-剂量临床研究结束点时体重增加≥7%成年患者的百分比。 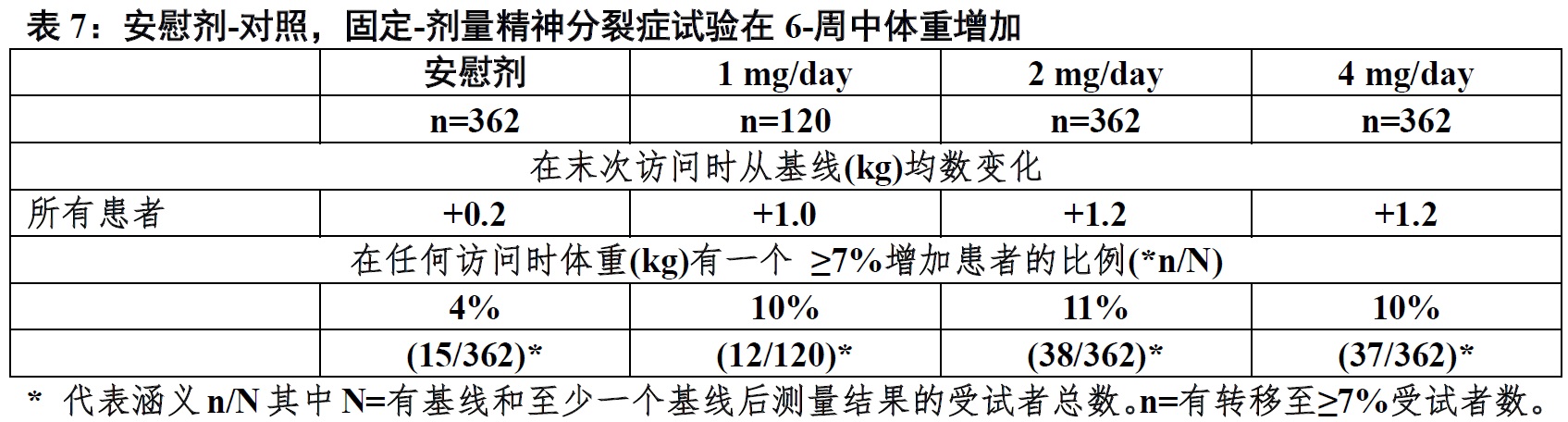
在长期,开放精神分裂症研究,0.6%的患者由于体重增加终止。REXULTI是伴随在26周时体重从基线均数变化1.3 kg和在52周时2.0 kg。在长期,开放精神分裂症研究,20%患者显示一个体重增加 ≥7%和10%显示体重减低 ≥7%。
5.7 白细胞减少,中性粒细胞减少,和粒细胞减少症
在临床试验中和/或上市后经验,曾报道暂时地与非典型的抗精神病药的白细胞减少和中性粒细胞减少。还曾报道粒细胞减少症。
对白细胞减少/中性粒细胞减少可能的风险因子包括预先-存在低白细胞计数(WBC)/绝对嗜中性计数(ANC)和药物-诱导白细胞减少/中性粒细胞减少史。在有临床上显著低WBC/ANC或药物-诱导白细胞减少/中性粒细胞减少病史患者中,治疗的头几个月频繁地进行完全血细胞计数(CBC)。在这类患者中,在缺乏其他致病因子时,在WBC首次临床上显著下降征象时考虑终止REXULTI 。
监视有临床上显著中性粒细胞减少患者发热或感染的其他症状或体征和如这类症状或体征发生及时治疗。在有严重中性粒细胞减少患者(绝对嗜中性计数<1000/mm3)终止REXULTI和跟踪他们的WBC直至恢复。
5.8 体位性低血压和昏厥
在有MDD患者REXULTI+ADT的短期,安慰剂-对照临床研究中,REXULTI+ADT-治疗患者与安慰剂+ADT患者比较体位性低血压-相关不良反应的发生率包括:眩晕(2%相比2%)和体位性低血压(0.1%相比0%)。在有精神分裂症患者中REXULTI的短期,安慰剂对照临床研究,REXULTI-治疗与安慰剂患者比较体位性低血压-相关不良反应的发生率中包括:眩晕(2%相比2%),体位性低血压(0.4%相比0.2%),和昏厥(0.1%相比0%)。
伴随体位性低血压不良反应可能包括眩晕,头重脚轻和心动过速。一般说来,在治疗开始时和剂量递增期间这些风险最大。在这些不良反应风险增加或在发生来自低血压并发症风险增加患者包括那些有脱水,低血容量,用抗高血压药治疗,心血管疾病病史(如,心力衰竭,心肌梗死,缺血,或传导异常),脑血管病史,以及患者是抗精神病药-未用过。在这类患者中,考虑使用较低开始剂量和较慢滴定调整,和监视体位性生命体征。
5.9 癫痫发作
如同其他抗精神病药,癫痫发作病史患者或有情况潜在地较低癫痫发作阈值应谨慎使用REXULTI。
在65岁或以上患者降低癫痫发作阈值条件可能更普遍。.
5.10 体温失调
身体减低核心体温能力的破坏曾被归咎于抗精神病药。当处方REXULTI 对患者将被经历情况可能升高核心体温时,如,激烈运动,暴露于极高热,同时接受有抗胆碱能活性药物,或正在受到脱水时,劝告适当护理。
5.11 吞咽困难
伴随抗精神病药使用时食管运动和抽吸功能障碍。处于有吸入性肺炎风险患者应谨慎使用抗精神病药,包括REXULTI。
5.12 对认知和运动功能障潜能
在有MDD患者短期,安慰剂-对照临床试验中,REXULTI+ADT-治疗患者报道思睡(包括镇静和嗜睡)4%与之比较安慰剂+ADT患者为1%。
在有精神分裂症患者短期,安慰剂-对照临床试验中,5%的REXULTI治疗患者报道思睡(包括镇静和嗜睡)与之比较安慰剂-治疗患者为3%。
如同其他抗精神病药一样有损伤判断,思想或运动技能潜能,患者应谨慎操作危险性机械包括汽车直至确信REXULTI治疗对他们没有不良影响。
6 不良反应
在说明书其他节中更详细讨论以下不良反应:
● 在老年患者与老年痴呆症有关的精神病增加死亡率[见黑框警告,警告和注意事项(5.1)]
● 自杀想法和行为 in 青少年和Young 成年[见黑框警告,警告和注意事项(5.2)]
● 老年患者与老年痴呆症有关的精神病脑血管不良反应包括卒中[见警告和注意事项(5.3)]
● 神经阻滞剂恶性综合征(NMS)[见警告和注意事项(5.4)]
● 迟发性运动障碍[见警告和注意事项(5.5)]
● 代谢变化[见警告和注意事项(5.6)]
● 白细胞减少,中性粒细胞减少,和粒细胞减少症[见警告和注意事项(5.7)]
● 体位性低血压和昏厥[见警告和注意事项(5.8)]
● 癫痫发作[见警告和注意事项(5.9)]
● 体温失调[见警告和注意事项(5.10)]
● 吞咽困难[见警告和注意事项(5.11)]
● 对认知和运动功能障潜能[见警告和注意事项(5.12)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
重性抑郁症
在1,054 例患者(18至65岁)被诊断有MDD患者参加在有重性抑郁症患者两项 6-周,安慰剂-对照,固定-剂量临床试验中评价REXULTI的安全性,其中REXULTI被给予在剂量1 mg至3 mg每天作为辅助治疗继续抗抑郁剂治疗;在安慰剂组中患者继续接受抗抑郁剂治疗[见临床研究(14.1)]。
报道的不良反应作为终止治疗的理由
总共3%(17/643) REXULTI-治疗患者和1%(3/411)安慰剂-治疗患者由于不良反应终止。
常见不良反应
在表8中显示不良反应伴随辅助使用REXULTI(发生率2%或更大和辅助REXULTI发生率大于辅助安慰剂) 发生在急性治疗期间(至 6-周在有MDD患者)。 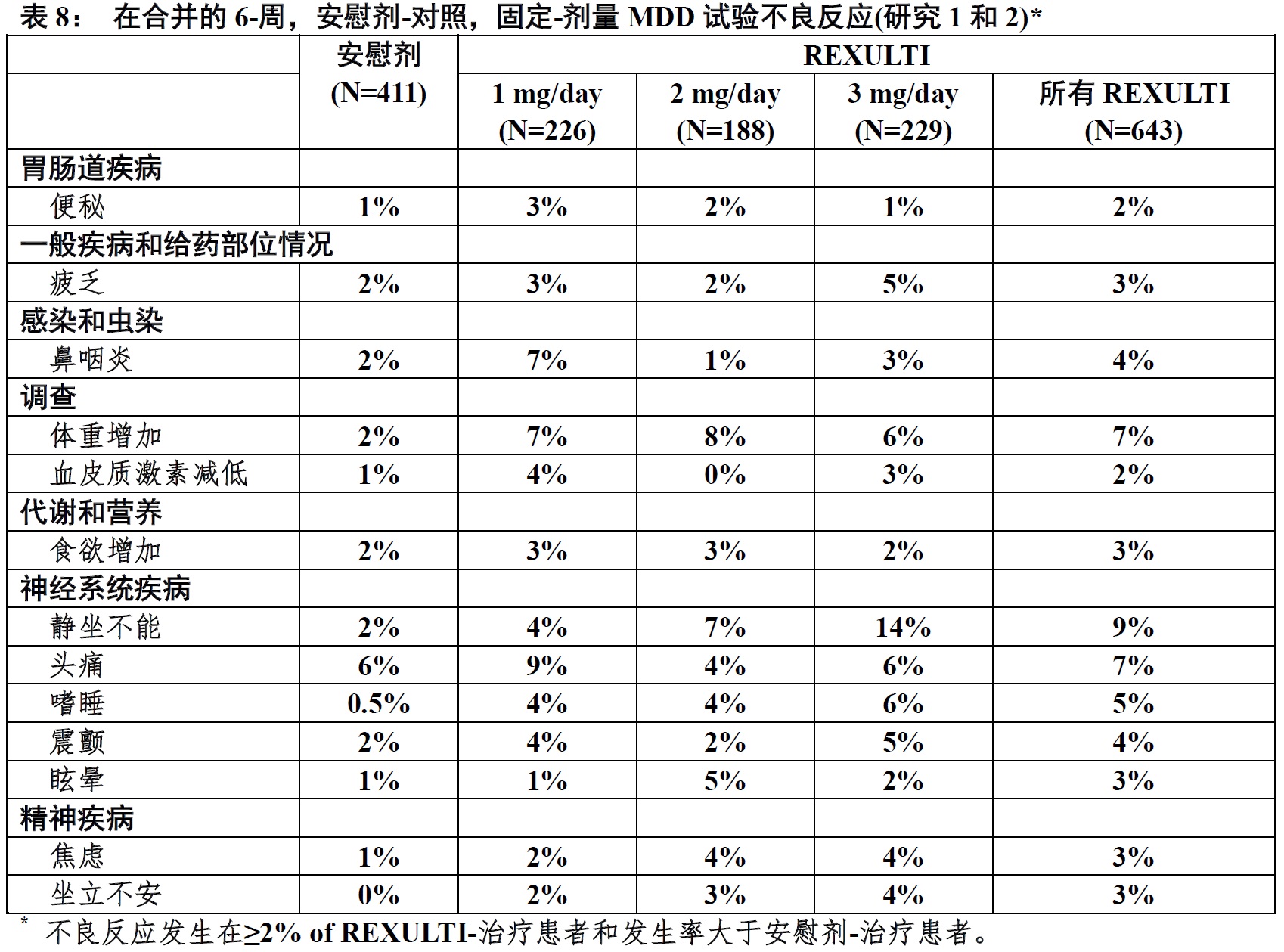
在 MDD试验中剂量-相关不良反应
在研究 1和2中,用REXULTI +ADT治疗患者发生率发生≥2%不良反应中,静坐不能和坐立不安的发生率随剂量增加而增加。
精神分裂症
参加两项6-周,安慰剂-对照,固定-剂量临床试验其中REXULTI被给予在每天剂量1 mg,2 mg和4 mg在852例患者(18至65岁)被诊断有精神分裂症中评价REXULTI的安全性[见临床研究(14.2)]。
常见不良反应
表9中显示短-期至6-周)试验时有精神分裂症患者伴随REXULTI不良反应(发生率2%或更大和REXULTI发生率大于安慰剂)。 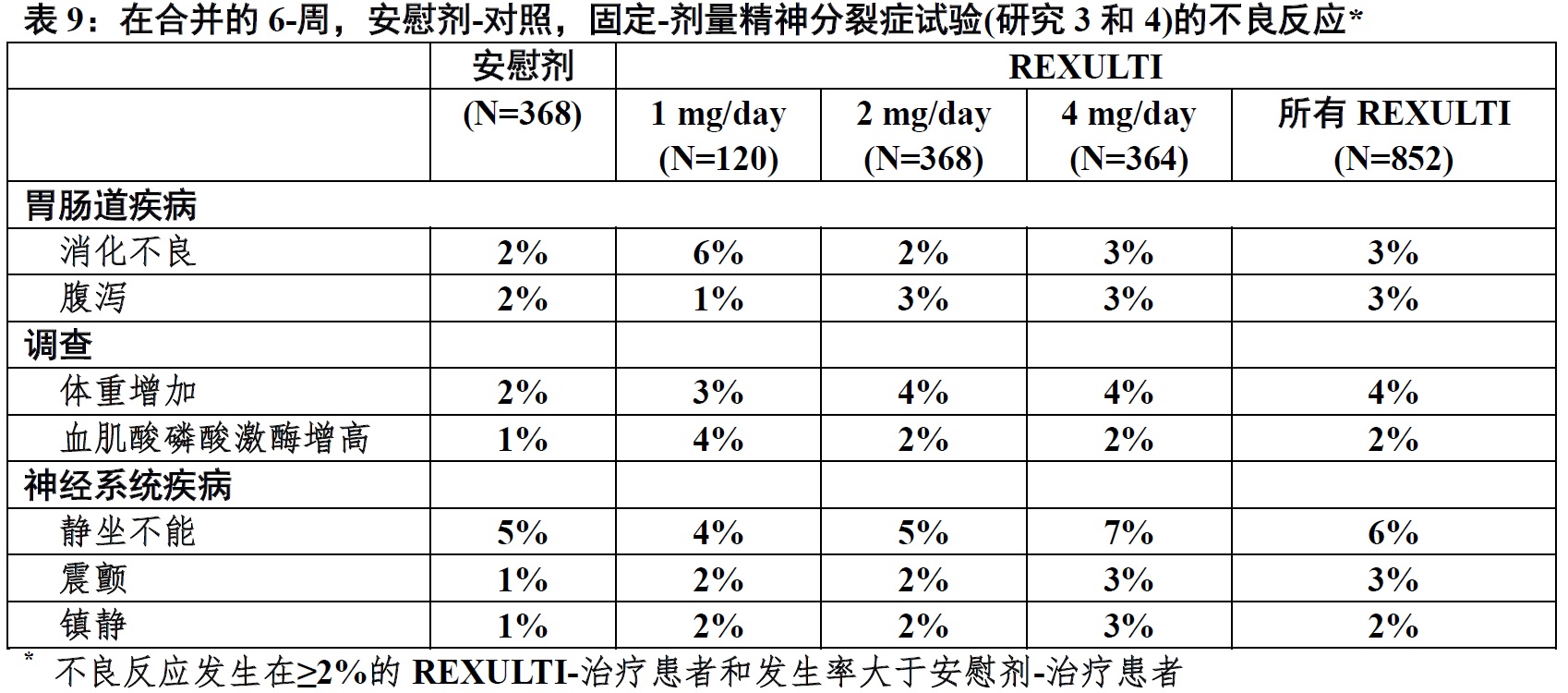
锥体外系症状[EPS]
重性抑郁症
报道的EPS-相关不良反应的发生率,排除静坐不能,是6%对REXULTI+ADT-治疗患者相比对安慰剂+ADT-治疗患者3%。静坐不能事件的发生率对REXULTI+ADT-治疗患者是9%相比对安慰剂+ADT-治疗患者为2%。
在6-周,安慰剂-对照MDD研究,在辛普森安格斯量表[Simpson Angus Rating Scale,SAS]对锥体外系症状(EPS),对静坐不能用巴恩斯静坐不能评定量表[Barnes Akathisia Rating Scale,BARS)和对运动障碍用异常不自主运动评分[Abnormal Involuntary Movement Score,AIMS) 客观地收集数据。对REXULTI+ADT-治疗患者对SAS,BARS和AIMS从基线平均变化至少访问是与安慰剂治疗患者有可比性。在REXULTI+ADT-治疗患者从正常移动至异常患者的百分比相比安慰剂+ADT较大对BARS(4%相比0.6%)和对SAS(4%相比3%)。
精神分裂症
报道的EPS-相关不良反应的发生率,排除静坐不能, 对REXULTI-治疗患者是5%相比对安慰剂-治疗患者4%。静坐不能事件的发生率对REXULTI-治疗患者是6%相比对安慰剂-治疗患者为5%。
在6-周,安慰剂-对照,固定-剂量精神分裂症研究,用辛普森安格斯量表(SAS)对锥体外系症状(EPS),巴恩斯静坐不能评定量表(BARS)对静坐不能和异常不自主运动评分(AIMS)对运动障碍客观收集数据。对REXULTI-治疗患者对SAS,BARS和AIMS从基线平均变化至少访问是与安慰剂治疗患者有可比性。在REXULTI-治疗患者相比安慰剂移动至异常患者的百分比较大对BARS (2%相比1%)和SAS(7%相比5%)。
张力障碍
在易感性个体中在治疗的头少数天期间可能发生张力障碍的症状。张力障碍症状包括:颈部肌肉痉挛,有时 发展到咽喉的松紧度,吞咽困难,呼吸困难,和/或舌的突出。而这些症状可能发生在低剂量,它们发生更频和有更多严重程度有高效力和在第一代抗精神病药在较高剂量。观察到在男性和较年轻年龄组急性张力障碍风险升高。
REXULTI上市前评价期间观察到的其他不良反应
下面显示有MDD和精神分裂症患者短期,安慰剂-对照试验内其他不良反应(≥1%频数和大于安慰剂)。以下列出不包括不良反应:1) 以前表或说明书其他处早已列出,2) 对药物原因远隔,3) 如此一般被认为没有信息意义,4) 被认为没有显著临床意义,或5) 其发生率等同或低于安慰剂。
眼疾病:视力模糊
胃肠道疾病:恶心,口干,唾液过度分泌,腹痛,腹胀
感染和虫染:泌尿道感染
调查:血催乳素增加
肌肉骨骼和结缔组织疾病:肌痛
精神疾病:异常梦,失眠
皮肤和皮下组织疾病:多汗症
7 药物相互作用
7.1与REXULTI有临床重要相互作用药物

7.2 与REXULTI无临床上重要相互作用药物
根据药代动力学研究,当与CYP2B6抑制剂(如,噻氯匹定[ticlopidine])或胃pH修饰剂(如,奥美拉唑[omeprazole])同时地给予REXULTI剂量无需调整。此外,对CYP2D6(如,右美沙芬[dextromethorphan]),CYP3A4(如,洛伐他汀[lovastatin]),CYP2B6(如, 安非他酮[bupropion]),BCRP(如,罗苏伐他汀[rosuvastatin]),或P-gp(如,非索非那定[fexofenadine])的底物当与REXULTI同时地给予无需剂量调整。
8 在特殊人群中使用
8.1 妊娠
妊娠暴露注册
有一个妊娠暴露注册监视妊娠期间暴露于REXULTI妇女中妊娠结局。为对非典型的抗精神病药更多信息联系美国国家妊娠注册电话1-866-961-2388或访问 http://womensmentalhealth.org/临床-and-research-programs/妊娠registry/。
风险总结
在妊娠妇女未曾用REXULTI进行适当和对照良好研究告知药物-相关风险。但是,新生儿母亲妊娠第三个三个月期间被暴露于抗精神病药,像REXULTI,是处于对锥体外系和/或戒断症状风险。动物生殖研究,在器官形成期用口服给予brexpiprazole至妊娠大鼠和兔,剂量在mg/m2基础上至在人最大推荐人用剂量(MRHD)4 mg/day的分别73和146倍。但是,当妊娠大鼠在器官形成期直至哺乳被给予brexpiprazole,在剂量MRHD的73倍,幼畜围产期死亡数增加[见数据]。不知道对适应证人群主要出生缺陷和流产的背景风险。在美国一般人群,估计临床上承认怀孕的主要出生缺陷和流产的背景风险分别是2-4%和15-20%。
临床考虑
胎儿/新生儿不良反应
曾报道母亲在妊娠第三个三个月期间被暴露于抗精神病药的新生儿中锥体外系和/或戒断症状,包括激动,张力亢进,肌张力低下,震颤,嗜睡,呼吸窘迫和喂养障碍。这些症状严重程度有变化。有些新生儿没有特异性治疗在几小时或几天内恢复;其他需要长期住院。监视 新生儿锥体外系和/或戒断症状和适当地处置症状。
数据
动物数据
妊娠大鼠在器官形成期阶段时用brexpiprazole口服剂量3,10,和30 mg/kg/day处理(在mg/m2基础上为MRHD的7.3,24,和73倍)。在剂量至MRHD的73倍Brexpiprazole不是致畸胎性和不致不良发育影响。
妊娠兔在器官形成期时被口服brexpiprazole剂量10,30,和150 mg/kg/day处理(MRHD的49,146,和730倍)。
Brexpiprazole在剂量至 MRHD的146 倍不是致畸胎性和不致不良发育影响。在MRHD的730倍,一个诱发母体毒性的剂量,观察到体重减低,骨化延迟,和内脏和骨骼变异的发现。
在一项研究中,妊娠大鼠在器官形成期和至哺乳被给予口服剂量3,10,和30 mg/kg/day(MRHD的7.3,24,和73倍),在MRHD的73倍剂量活-出生幼畜数减低和产后早期死亡增加。在MRHD的73倍时观察到幼畜被母兽哺乳受损,和低出生体重和体重增加减低,但24倍时没有。
8.2 哺乳
风险总结
未进行哺乳研究评估在乳汁中brexpiprazole的存在,brexpiprazole对哺乳喂养婴儿的影响,或brexpiprazole对乳汁生成的影响。Brexpiprazole是存在于大鼠乳汁中。哺乳喂养对发育和健康的获益应与母亲对REXULTI的临床需求和对哺乳喂养婴儿来自REXULTI或来自母体所患情况任何潜在不良效应一起考虑。
8.4儿童使用
尚未确定在儿童患者中安全性和有效性。在儿童患者中抗抑郁药增加自杀想法和行为的风险 [见黑框警告,警告和注意事项(5.2)]。
8.5 老年人使用
REXULTI疗效的临床研究没有包括任何患者年龄65或以上已确定他们的反应是否不同于较年轻患者。一般说来,对一位老年患者剂量选择应谨慎,通常在给药剂量范围低端开始,反映减低肝,肾,和心脏功能,同时疾病,和其他药物治疗的更大频度。
根据一项安全性,耐受性和药代力学试验的结果,每天1次口服给予brexpiprazole(至3 mg/day共14天)作为一种辅助治疗在老年受试者(70至85岁, N=11)有MDD的治疗的药代动力学与有MDD成年受试者中观察到的药代动力学是有可比性。
在有痴呆-相关精神病老年患者中抗精神病药增加死亡的风险。REXULTI没有被批准为有痴呆相关精神病患者的治疗[见黑框警告,警告和注意事项(5.1)]。
8.6 CYP2D6弱代谢者
在已知的CYP2D6弱代谢者中建议剂量调整,因为这些患者比CYP2D6的正常代谢者有较高 brexpiprazole浓度。
约8%高加索人和3–8%黑种/非洲美国人不能代谢CYP2D6底物和被分类为弱代谢者(PM)[见剂量和给药方法(2.5),临床药理学(12.3)]。
8.7 肝受损
在有中度至严重肝受损(Child-Pugh评分 ≥7)患者中减低最大推荐剂量。有中度至严重肝受损(Child-Pugh评分≥7)患者一般地比有正常肝功能患者对brexpiprazole暴露较高[见临床药理学(12.3)]。较大暴露可能增加REXULTI-相关不良反应的风险[见剂量和给药方法(2.3)]。
8.8肾受损
在有中度,严重,或终末期肾受损(CLcr<60 mL/minute)患者中最大推荐剂量减低。有受损的肾功能患者(CLcr<60 mL/minute)比有正常肾功能患者有对brexpiprazole暴露较高[见临床药理学(12.3)]。更大暴露可能增加REXULTI-相关不良反应的风险[见剂量和给药方法(2.4)]。
8.9 其他特殊人群
不需要在患者的性别,种族,或吸烟状态的基础上调整REXULTI的剂量[见临床药理学(12.3)]。
9 药物滥用和依赖性
9.1 受控物质
REXULTI不是受控物质。
9.2 滥用
动物给予可取到REXULTI没有自我给予药物,提示REXULTI没有奖赏性质。
9.3 依赖性
接受慢性 REXULTI给予的人和动物对药物终止没有显示任何撤药体征。这提示REXULTI不产生身体依赖性。
10 药物过量
关于人用过量REXULTI经验有限临床试验。咨询一个经认证的毒物控制中心(1-800-222-1222或www.poison.org)为更新指导和咨询关于REXULTI过量。过量的处理应重点在支持治疗,维持一个适当的气道,加氧和通气,和症状的处理。密切医疗监督和应继续监视直至患者恢复。
活性炭
口服活化的活性炭和山梨糖醇(50 g/240 mL),在口服摄入brexpiprazole后一小时给予,分别减低brexpiprazole Cmax和曲线下面积(AUC)约 5%至23%和31%至39%;但是,关于活性炭在治疗用REXULTI过量的治疗潜能可得到的信息不够充分。
血液透析
没有血液透析治疗REXULTI过量影响的信息;血液透析可能没有用处因为brexpiprazole是与血浆蛋白高度结合。
11 一般描述
Brexpiprazole,一种非典型的抗精神病药,是可得到为REXULTI®(brexpiprazole)片。Brexpiprazole是7-{4-[4-(1-Benzothiophen-4-yl)piperazin-1-yl]butoxy}quinolin2(1H)-one。经验式为C25H27N3O2S和分子量为433.57。化学结构为:
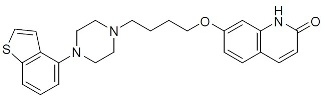
REXULTI片是为口服给药和可得到0.25 mg,0.5 mg,1 mg, 2 mg,3 mg和4 mg强度规格。无活性成分包括一水乳糖,玉米淀粉,微晶纤维素,羟丙基纤维素,低取代羟丙基纤维素,硬脂酸镁,羟丙甲纤维素,和滑石。着色剂包括二氧化钛,氧化铁和四氧化三铁。
12 临床药理学
12.1 作用机制
不知道Brexpiprazole在重性抑郁症或精神分裂症治疗中的作用机制。但是,brexpiprazole的疗效可能通过在五羟色胺5-HT1A和多巴胺D2 受体部分激动剂活性,和在五羟色胺5-HT2A受体拮抗剂活性的组合介导。.
12.2 药效动力学
Brexpiprazole有亲和力(表达为Ki)对多种单胺受体包括五羟色胺5HT1A(0.12 nM),5HT2A(0.47 nM),5HT2B(1.9 nM),5HT7(3.7 nM),多巴胺D2(0.30 nM),D3(1.1 nM),和去甲肾上腺素α1A(3.8 nM),α1B(0.17 nM),α1D(2.6 nM),和α2C(0.59 nM)受体。Brexpiprazole作用如同一种部分激动剂在5HT1A,D2,和D3受体和如同一种拮抗剂在5HT2A,5HT2B,5HT7,α1A,α1B,α1D, 和α2C受体。Brexpiprazole还表现亲和力对组胺H1受体(19 nM)和对毒蕈碱M1受体(67%抑制作用在10 µM)。
心脏电生理学
在一个剂量3-倍MRHD为精神分裂症的治疗和4-倍MRHD为辅助治疗对抗抑郁剂为MDD的治疗,REXULTI不延长QTc间期至任何临床上相关程度。
12.3 药代动力学
吸收
REXULTI 片的单剂量给药后,在给药后4小时内发生血浆brexpiprazole峰浓度;和口服绝对生物利用度是95%。在给药后10-12天内得到Brexpiprazole 稳态浓度。
REXULTI可有或无食物给予。一个4 mg REXULTI片与一个标准高脂肪餐给没有显著影响brexpiprazole的Cmax或AUC。在单次和多次每天1次 剂量给药, brexpiprazole暴露(Cmax和AUC)与给予剂量成正比例增加。
Brexpiprazol的在体外研究不表明brexpiprazole是流出转运蛋白的底物例如MDRI(P-gp)和BCRP。
分布
静脉给药后brexpiprazole的分布容积是高(1.56±0.42 L/kg),表明血管外分布。Brexpiprazole在血浆中是高度蛋白结合(大于99%)至血清白蛋白和α1-酸性糖蛋白,和其蛋白结合不受肾或肝受损影响。根据在体外研究的结果,brexpiprazole蛋白结合不受 protein binding is not affected by华法林[warfarin],地西泮[diazepam],或地高辛[digitoxin]。
消除
代谢
根据在体外利用重组人细胞色素P450(CYP1A1,1A2,2A6,2B6,2C8,2C9,2C19,2D6,2E1,和3A4) brexpiprazole的代谢研究显示brexpiprazole的代谢主要通过CYP3A4 和CYP2D6介导。
在体内brexpirazole是主要地通过CYP3A4和CYP2D6 酶代谢。在单次-和多次-剂量给药后,brexpiprazole及其主要代谢物,DM-3411,是全身循环中占优势药物部分。在稳态中,DM-3411 代表血浆中brexpiprazole暴露(AUC)的23%至48%。DM-3411被认为对brexpiprazole的治疗效应没有贡献。
根据在体外数据,brexpiprazole 显示很小至没有CYP450 同工酶的抑制作用。
排泄
单次口服剂量[14C]-标记的brexpiprazole后,在尿和粪中分别约回收 25%和46%给予的放射活性。在尿中排泄低于1%的未变化brexpiprazole和在粪中回收约 14%未变化的口服剂量。每天1次brexpiprazole 口服片给药后表观口服清除率为19.8(±11.4) mL/h/kg。多次每天1次 REXULTI给药,brexpiprazole及其主要代谢物,DM-3411的末端消除半衰期分别是91小时和86小时。
在特殊人群中研究
图1中总结brexpiprazole在特殊人群中的暴露。
群体PK分析表明在有中度肾受损患者中与正常肾功能患者比较brexpiprazole暴露较高。

图1:内在因子对Brexpiprazole药代动力学的影响
药物相互作用研究
图2中总结其他药物对brexpiprazole暴露的影响。
根据模拟,当CYP2D6的强代谢者被给予强CYP2D6和CYP3A4 抑制剂二者在稳态时AUC值期望增加5.1-倍。在CYP2D6的弱代谢者给予强CYP3A4 抑制剂在稳态时均数AUC值期望增加4.8-倍[见药物相互作用(7.1)]。
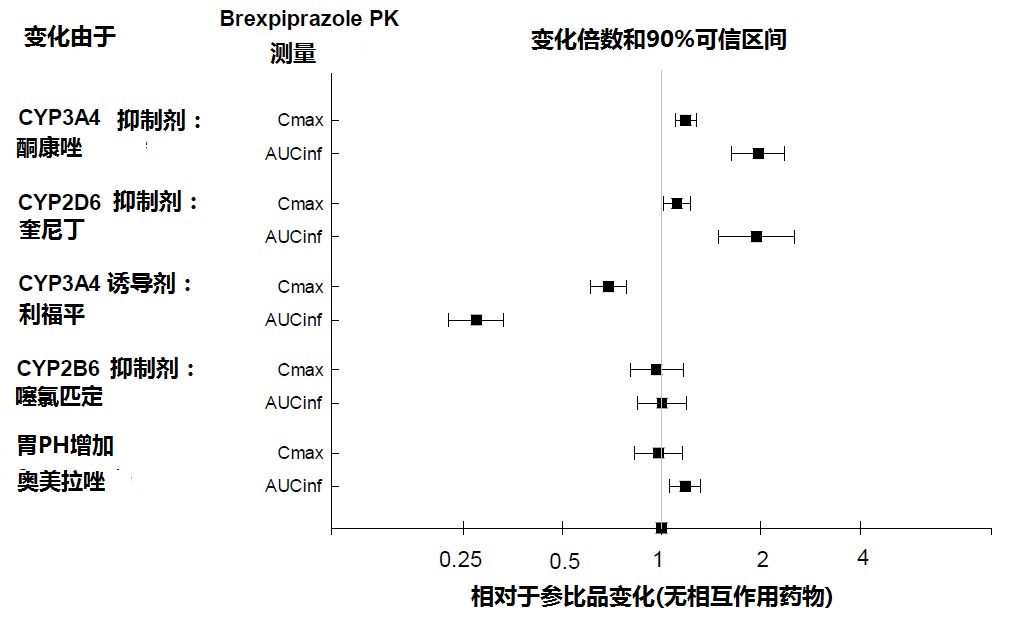
图2:其他药物对 Brexpiprazole 药代动力学的影响
图3总结 REXULTI对其他药物暴露的影响。
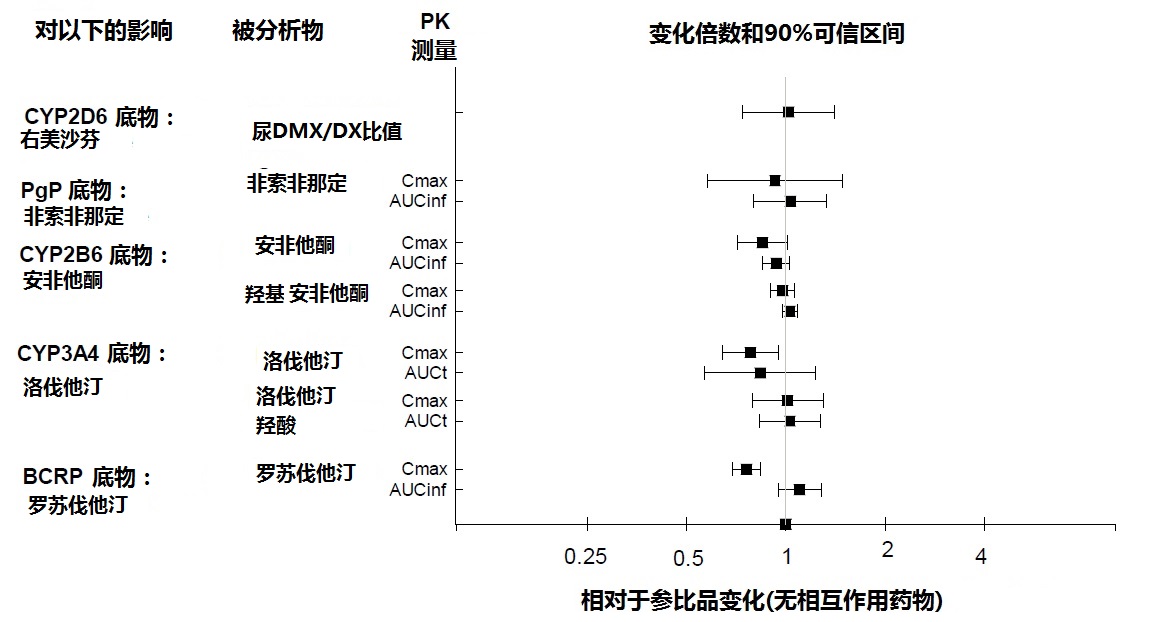
图3:REXULTI对其他药物药代动力学的影响。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
癌发生
在ICR 小鼠和SD大鼠中进行一生致癌性研究。口服给予Brexpiprazole雄性和雌性小鼠剂量0.75,2和5 mg/kg/day(根据mg/m2体表面积是口服MRHD 4 mg/day的0.9至6.1倍)和雄性和雌性大鼠剂量分别1,3,和10 mg/kg和3,10,和30 mg/kg/day(口服MRHD,雄性和雌性分别2.4至24和7.3至73倍)共2年。在雌性小鼠中,在所有剂量乳腺腺癌的发生率增加和在MRHD的2.4和6.1倍时腺鳞癌的发生率增加。在雄性小鼠中未观察到肿瘤的发生率增加。在大鼠研究中,在任一性别在剂量至MRHD的73倍brexpiprazole均无致癌性。
慢性给予抗精神病药后曾观察到啮齿动物乳腺和垂体腺体中增殖和/或肿瘤变化和被认为是催乳素介导。在小鼠和大鼠中均显示增加血清催乳素brexpiprazole的水平的潜能。不知道在啮齿类催乳素-介导内分泌肿瘤的发现对人类的风险。
突变发生
Brexpiprazole测试时不是致突变性,在体外细菌回复突变试验(Ames试验)。Brexpiprazole对致畸变活性是阴性在大鼠体内微核试验,和在体内/在体外大鼠程序外DNA合成试验不是遗传毒性. 在体外用哺乳动物细胞 brexpiprazole是致染色体断裂但只是在剂量诱发细胞毒性。 根据证据权重,不认为brexpiprazole对人存在遗传毒性。.
生育力受损
雌性大鼠用口服剂量0.3,3或30 mg/kg/day处理(在mg/m2基础上是口服MRHD的0.7,7.3,和73倍)在未处理雄性交配前和继续至受孕和着床。在3和30 mg/kg/day时观察到动情周期不规则和减低生育力。延长配对时间和在30 mg/kg/day观察到增加着床丢失。雄性大鼠用口服剂量3,10,或100 mg/kg/day处理(在mg/m2基础上为口服MRHD的7.3,24和240 倍)对用未处理雌性交配前63天和交配14天自始至终。在雄性在任何剂量brexpiprazole未观察到交配时间或生育力指数差别。
14 临床研究
14.1重性抑郁症的辅助治疗
在两项6-周,双盲,安慰剂-对照,固定-剂量试验符合DSM-IV-TR对MDD,标准对有或无焦虑症状成年患者中评价REXULTI在重性抑郁症(MDD)辅助治疗中的疗效,患者有一个对以前抗抑郁剂治疗(1至3个疗程)在当前发作中和患者还曾显示一个8周自始至终前瞻性抗抑郁剂治疗(用艾司西酞普兰[escitalopram],氟西汀,帕罗西汀控-释放,舍曲林[sertraline],度洛西汀延迟释放,或文拉法辛[venlafaxine]缓释)反应不佳。在前瞻性抗抑郁剂治疗期反应不佳被定义为在治疗疗程自始自终有持久症状无实质上改善。
患者在研究228(此后称为 “研究1”)被随机化至REXULTI 2 mg每天1次或安慰剂。在研究227(此后称为“研究2”)中患者被随机化至REXULTI 1或3 mg每天1次或安慰剂。对随机化至REXULTI患者,所有患者在第1周期间初始治疗在0.5 mg每天1次。在第2周,在所有治疗组中REXULTI 剂量被增加至1 mg ,和或维持在1 mg或增加至2 mg或3 mg每天1次,根据治疗赋予,从第3周开始。然后剂量被维持共4余下周。
主要终点是在蒙哥马利 - 艾森贝格抑郁量表[Montgomery-Asberg Depression Rating Scale,MADRS),一个10-项 临床相关评分用于评估抑郁症状学的程度,有0代表无症状,和60代表最坏症状,从基线至周6的变化
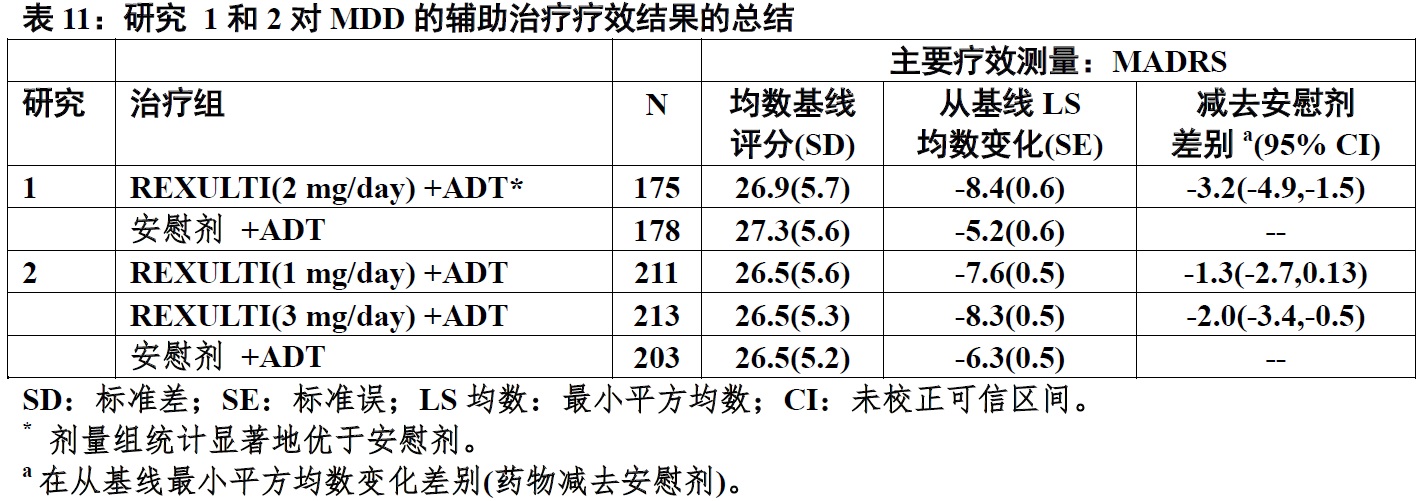
在随机化时,均数MADRS总评分是27。在研究1和2,在减低均数MADRS总评分方面,REXULTI(+抗抑郁剂(ADT))2 mg/day和3 mg/day为优于安慰剂 + ADT。在下面表11中显示来自两个固定剂量试验主要疗效参数的结果。下面图4显示在研究1中根据主要疗效测量(MADRS)反应的时间过程。
人群亚组的一个检查提示根据年龄,性别,种族或前瞻性抗抑郁剂的选择提示不鉴别反应。
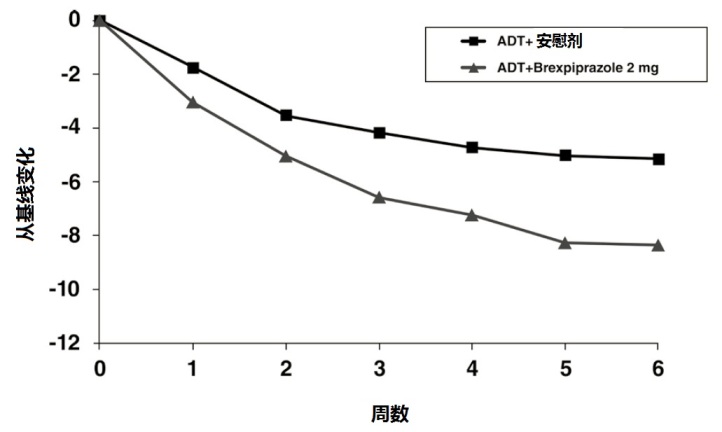
图4:在研究1中有 MDD患者按研究访问MADRS总评分从基线变化。
14.2 精神分裂症
在两项6-周,随机化,双盲,安慰剂-对照,固定-剂量临床试验显示在符合DSM-IV-TR准对精神分裂症患者中有精神分裂症成年治疗中REXULTI的疗效。
在两项研究中,研究231(此后称“研究3”)和研究230(此后称“研究4”),患者被随机化至REXULTI 2或4 mg每天1次或安慰剂。在REXULTI组中患者起始治疗在第1质天在1 mg每天1次。第5至7天REXULTI剂量被增至2 mg。然后剂量或维持在2 mg每天1次或增至4 mg每天1次,取决于对其余5周治疗赋予。
两试验的主要疗效终点是阳性和阴性综合证评分(PANSS)总评分从基线至6周变化。PANSS是一个30-项评分测量精神分裂症的阳性症状(7项),精神分裂症的阴性症状(7项),和一般精神病理学(16项),各项在一个1(无)至7(极度)标尺上计分;总PANSS评分范围从30(最佳)至210(最坏)。
在研究3中,REXULTI在两个2 mg/day和4 mg/day是在PANSS总评分上优于安慰剂。在研究4中,REXULTI 4 mg/day是在PANSS总评分上优于安慰剂(表12)。图5显示在研究3中根据主要疗效测量反应时间过程(PANSS总评分从基线变化)。
人群亚组的检查根据年龄,性别和种族不提示反应性差别。
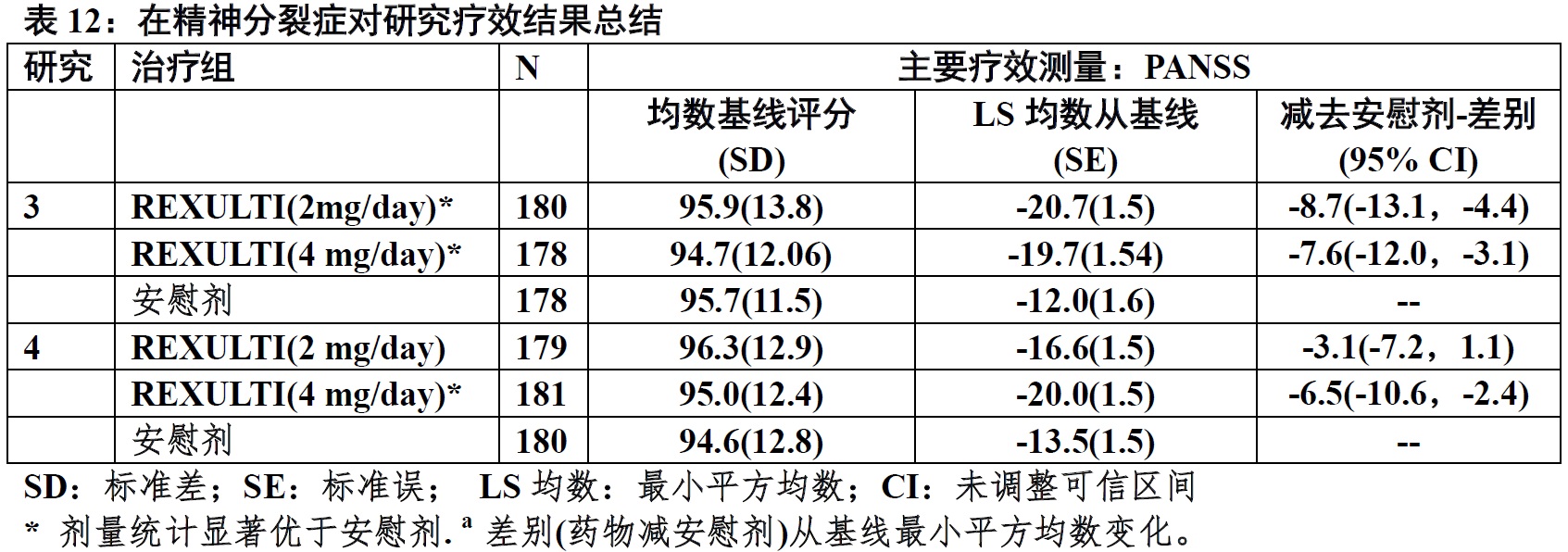
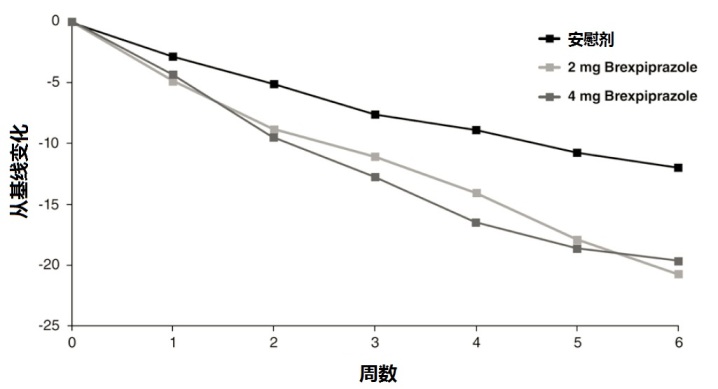
图5:研究3中在有精神分裂症患者总评分从基线变化按研究随访(周)。
16 如何供应/贮存和处置
16.1 如何供应
REXULTI(brexpiprazole)片在一侧有标记,和得到以下强度规格和包装结构(见表13): 
16.2 贮存
贮藏REXULTI片在20°C至25°C(68°F至77°F);外出允许15°C至30°C(59°F至86°F)[见USP 控室温]。
17 患者咨询资料
忠告患者或看护人员阅读FDA-批准的患者说明书(用药指南)。
自杀想法和行为
忠告患者和看护人员寻找自杀的出现,尤其是早期治疗期间和当向上或下调整剂量时和指导他们报告这类症状至卫生保健提供者[见黑框警告,警告和注意事项(5.2)]。
剂量和给药方法
忠告患者REXULTI可有或无食物服用。忠告患者关于下列剂量递增指导的重要性[见剂量和给药方法(2.1),(2.2)].
神经阻滞剂恶性综合征(NMS)
与患者商讨伴随给予抗精神病药曾报道关于潜在地致命性不良反应− 神经阻滞剂恶性综合征(NMS)。忠告患者如他们经历NMS的体征或症状联系卫生保健提供者或报告至急诊室[见警告和注意事项(5.4)]。
迟发性运动障碍
与患者商讨迟发性运动障碍体征和症状和如发生这些异常运动联系卫生保健提供者[见警告和注意事项(5.5)]。
代谢变化
教育患者关于代谢变化的风险,如何识别高血糖和糖尿病的症状,和需要特异性监视,包括血糖,脂质,和体重[见警告和注意事项(5.6)]。
白细胞减少,中性粒细胞减少和粒细胞减少症
忠告患者有预先存在低WBC或药物诱导白细胞减少/中性粒细胞减少病史当服用REXULTI 他们应有全血细胞计数CBC 监视[见警告和注意事项(5.7)]。
体位性低血压和昏厥
教育患者关于体位性低血压和昏厥的风险尤其是治疗早期,和还有再次-开始治疗或增加剂量时[见警告和注意事项(5.8)]。
热暴露和脱水
与患者商讨关于适当护理避免过热和脱水[见警告和注意事项(5.10)]。
有认知和运动性能干预
患者谨慎进行需要精神警戒活动,例如操作危险机械或汽车,直至他们被有理由确认REXULTI 治疗对他们从事这类活动没有不良影响[见警告和注意事项(5.12)]。
同时药物
忠告患者他们的当前处方或非处方药任何变化告知他们的卫生保健提供者因为对临床上显著相互作用有潜在影响[见药物相互作用(7.1)]。
妊娠
忠告患者在妊娠的第三个三个月使用REXULTI可能致新生儿中锥体外系和/或戒断症状和有已知的或怀疑妊娠告知他们的卫生保健提供者。忠告患者有妊娠暴露注册监视妊娠期间妇女暴露于REXULTI妊娠结局[见在特殊人群中使用(8.1)]

