批准日期:2015年7月24日;公司:Sanofi和Regeneron 制药
可注射降胆固醇药物的新类别中第一个。药物评价和研究中心新药办公室主任说:“对有HeFH或有已知的心血管病患者用他汀类药物未能足够降低他们的LDL胆固醇Praluent提供另外治疗选择,” “FDA强力支持继续工作以提供新和创新选择为治疗和预防心血管病。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/125559Orig1s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用PRALUENT所需所有资料。请参阅PRALUENT完整处方资料。
PRALUENTTM(alirocumab)注射液,为皮下使用
美国初次批准:2015
适应证和用途
PRALUENT是一种PCSK9(前蛋白转化酶枯草溶菌素9型)抑制剂抗体适用作为对膳食和最大耐受他汀类治疗辅助为治疗有杂合子家族性高胆固醇血症或临床动脉粥样硬化心血管病,需要LDL-胆固醇(LDL-C)另外降低的成年。(1.1)
尚未确定PRALUENT对心血管发病率和死亡率的影响。(1.2)
剂量和给药方法
推荐的PRALUENT起始剂量为皮下给药,每2周一次75mg,因为大多数患者用该剂量达到足够的LDL-C降低。 对于喜欢较低频率给药的患者,另一种起始剂量是每4周300mg(每月一次),如果LDL-C反应不充分,可将剂量调整至每2周施用150mg的最大剂量。
剂型和规格
⑴注射液:75 mg/mL或150 mg/mL溶液在一个单剂量预装笔中(3)
⑵注射液:75 mg/mL或150 mg/mL溶液在一个单剂量预装注射器中(3)
禁忌证
对PRALUENT严重超敏性反应病史。(4)
警告和注意事项
用PRALUENT治疗曾报道过敏反应:超敏性反应(如,瘙痒,皮疹,寻麻症),包括有些严重事件(如,超敏性血管炎和超敏性反应需要住院)。如发生严重过敏反应的体征和症状,终止用PRALUENT治疗,按照标准医护处理,和监视直至体征和症状解决。
不良反应
最常发生不良反应(≥5%的用PRALUENT治疗患者和发生更频于安慰剂)是鼻咽炎,注射部位反应,和流感。(6.1)
报告怀疑不良反应,联系Sanofi电话1-800-633-1610或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
完整处方资料
1 适应证和用途
1.1 原发性高脂血症
PRALUENT适用为作为杂合子家族性高胆固醇血症或临床动脉粥样硬化心血管病需要LDL-C另外降低的成年饮食和最大地耐受他汀类治疗的辅助治疗。
1.2 使用限制
尚未确定PRALUENT对心血管发病率和死亡率的影响。
2 剂量和给药方法
2.1 给药信息
PRALUENT的推荐起始剂量是75 mg皮下给药每2周1次,自从患者大多数用这个剂量实现足够的LDL-C降低。如LDL-C反应不佳,剂量可增加至每2周给予最大剂量150 mg。
开始的4至8周内测定LDL-C水平或如必要时滴定调整PRALUENT评估反应和调整剂量。
如缺失一剂,指导患者从缺失剂量7天内给予注射和然后恢复患者原始时间表。如缺失剂量没有在7天给予,指导患者等待直至原始时间表上下一次剂量。
2.2 重要给药指导
●使用前按照使用指导对患者和/或护理人员对PRALUENT的制备和给予提供适当训练。在每次使用时指导患者和/或护理人员阅读和遵循使用指导。
●使用前允许PRALUENT加温至室温共30至40分钟。加温后尽可能立即使用PRALUENT。如果它曾在室温[77°F(25°C)]放置共24小时或更长。不要使用PRALUENT。
●非肠道药品在给药前应肉眼观察有无颗粒物质和变色。如溶液变色或含可见颗粒物质,不应使用该溶液。
●每次给予PRALUENT 遵循无菌术。
●利用一个单剂量预装笔或单剂量预装注射器通过皮下注射至大腿,腹部,或上臂给予PRALUENT。
●每次注射轮转注射部位。
●不要注射PRALUENT至有活动性疾病或损伤的区域例如烧伤,皮疹,炎症,或皮肤感染。
●PRALUENT不要与其他可注射药物在相同注射部位共同给药。
3 剂型和规格
PRALUENT是一种透明,无色至浅黄色溶液可得到以下:
注射液:单剂量预装笔
●75 mg/mL
●150 mg/mL
注射液:单剂量预装注射器
●75 mg/mL
●150 mg/mL
4 禁忌证
对PRALUENT严重超敏性反应病史患者禁忌PRALUENT。反应已包括超敏性血管炎和超敏性反应需要住院。[见警告和注意事项(5.1)]
5 警告和注意事项
5.1 过敏反应
用PRALUENT治疗曾报道超敏性反应(如,瘙痒,皮疹,寻麻症),包括有些严重事件(如,超敏性血管炎和超敏性反应需要住院)。如发生严重过敏反应的体征和症状,终止治疗用PRALUENT,按照标准医护,和监视直至体征和症状解决[见禁忌证(4)]。
6 不良反应
在说明书其他节也讨论以下不良反应:
● 过敏反应[见警告和注意事项(5.1)。]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在9项安慰剂对照试验包括2476例用PRALUENT治疗患者,包括2135例暴露共6个月和1999例暴露共长于1年(中位治疗时间65周)评价PRALUENT的安全性。人群均数年龄为59岁,人群40% 是妇女,90%是高加索人,4%是黑种人或非洲美国人,和3%是亚裔。在基线时,37%患者有一个杂合子家族性高胆固醇血症的诊断和66%有临床动脉粥样硬化心血管病。
在表1中显示至少2%的PRALUENT-治疗患者报道,和比安慰剂-治疗患者更频的不良反应。
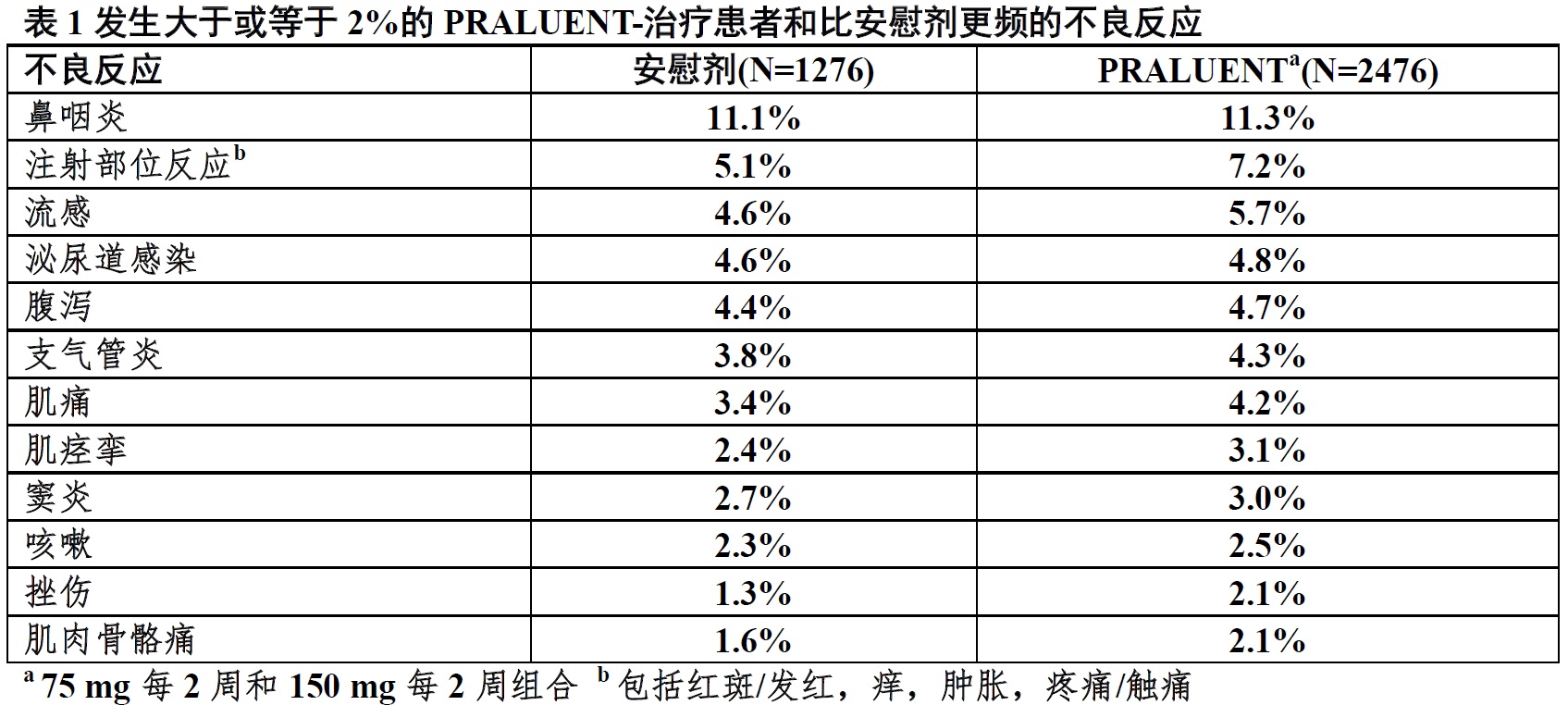
用PRALUENT治疗患者5.3%因不良反应导致终止治疗和用安慰剂治疗患者5.1%。用PRALUENT治疗患者导致治疗终止最常见不良反应是过敏反应(对PRALUENT和安慰剂分别0.6%相比0.2%)和升高的肝酶(0.3%相比<0.1%)。
局部注射部位反应
用PRALUENT治疗患者局部注射部位反应包括红斑/发红,痒,肿胀,和疼痛/触痛被更频报道(对PRALUENT和安慰剂分别7.2%相比5.1%)。少数患者因为这些反应终止治疗(对PRALUENT和安慰剂分别0.2%相比0.4%),但接受PRALUENT患者比接受安慰剂患者有更大数量的注射部位反应,有更多报告伴症状,和有更长平均时间的反应。
过敏反应
用PRALUENT治疗患者比用安慰剂治疗患者中更频地报道过敏反应(8.6%相比7.8%)。由于过敏反应终止治疗患者的比例在用PRALUENT治疗患者中较高(0.6%相比0.2%)。在对照临床试验中用PRALUENT患者报道严重性过敏反应,例如超敏性,钱币状湿疹[nummular eczema],和超敏性血管炎[见警告和注意事项(5.1)]。
神经认知事件
用PRALUENT治疗患者0.8%和用安慰剂治疗患者0.7%报道神经认知事件。用PRALUENT治疗患者(各自0.2%)比用安慰剂(各自<0.1%)更频地报道混乱或记忆受损。
肝酶异常
在用PRALUENT治疗患者2.5%和of用安慰剂治疗患者1.8%报道肝-相关疾病(主要地与肝酶中异常相关),分别导致0.4%和0.2%患者中治疗终止。用PRALUENT治疗患者1.7%和用安慰剂治疗患者1.4%发生血清转氨酶增加大于正常上限3倍。
低LDL-C值
在一项安慰剂-和阳性-对照临床二者合并试验中,796例PRALUENT-治疗患者有两次连续计算的LDL-C值<25 mg/dL,和288例有两次连续计算的LDL-C值<15 mg/dL。对低LDL-C值反应中没有做与背景脂质-改变治疗变化(如,最大地耐受的他汀类药物),和在这个基础上PRALUENT给药剂量没有修饰或中断。虽然在这些试验中没有确定非常低LDL-C的不良后果,不知道PRALUENT诱发非常低水平LDL-C的长期影响。
6.2 免疫原性
如同所有治疗性蛋白一样,存在用PRALUENT免疫原性的潜能。在10项安慰剂-和阳性-对照试验的合并中,在开始治疗后用PRALUENT治疗患者4.8%新检测到抗-药抗体(ADA)与之比较用对照治疗患者有0.6%。
发生抗药抗体ADA患者与不发生ADA患者有较高发生率的注射部位反应(10.2%相比.9%)。
用PRALUENT治疗患者总共发生1.2%中和抗体(NAb)至少一次与之比较对照处理患者没有,和0.3%的患者对NAb两者测试阳性和表现出短暂或延长丧失疗效。不知道存在持久NAb继续PRALUENT治疗的长期后果。
免疫原性数据是高度依赖于分析的灵敏度和特异性以及其他因子,包括样品处置,采样时间,同时药物,和所患疾病。由于这些理由,对PRALUENT抗体发生率与对其他产品抗体发生率的比较可能是误导。
8 特殊人群中使用
8.1 妊娠
风险总结
在妊娠妇女中在妊娠妇女中使用没有可得到的数据以告知药物-相关风险。在动物生殖研究中,当大鼠器官形成期间皮下给予alirocumab在剂量暴露至最大推荐人用剂量150 mg每两周的12-倍对胚胎-胎儿发育没有影响。在猴中,在婴猴当器官形成期至分娩间给予alirocumab在剂量在最大推荐人用剂量150 mg每两周暴露的13-倍时观察到抑制体液免疫反应。在剂量最大推荐人用剂量150 mg每两周暴露至81-倍时未观察到对妊娠或新生/婴畜发育另外的影响。在婴猴出生时观察到可测量的alirocumab血清浓度与母体血清可比性水平,表明alirocumab,像其他IgG 抗体,跨越胎盘屏障。FDA的在人类中用单克隆抗体的经验表明它们在第一个三个月很可能不跨越胎盘;但是,在第二个和第三个三个月透明可能以增加量跨越胎盘。在对妊娠妇女处方PRALUENT前考虑PRALUENT的获益和风险以及对胎儿可能的风险。
在美国一般人群,临床上公认的怀孕主要出生缺陷和流产的估算背景风险分别为2-4%和15-20%。
数据
动物数据
在Sprague Dawley大鼠中,在怀孕第6和12天当通过皮下途径给予alirocumab剂量至75 mg/kg/dose根据血清AUC在最大推荐人用剂量150 mg每两周暴露的12-倍时,对胚胎-胎儿发育未观察到影响。
在食蟹猴中,当在器官形成期间至分娩alirocumab通过皮下途径给予15 mg/kg/week和75 mg/kg/week,根据血清AUC相当于在最大推荐人用剂量150 mg每两周时人暴露13-和81-倍,在4至6个月月龄婴猴中观察到对锁眼血蓝蛋白[keyhole limpet hemocyanin, 癌发生)抗原的体液免疫反应的抑制。在猴中导致体液免疫抑制测试的最低剂量;因此不知道在临床暴露时是否观察到这个影响。没有进行研究被设计成挑战婴猴的免疫系统。当alirocumab是通过皮下途径给予剂量至75 mg/kg/week,根据血清AUC 相当于在最大推荐人用剂量150 mg每两周时母体暴露的81-倍。在婴猴中未观察到另外胚胎-胎儿,产前或产后效应,和未观察到母体效应,
8.2 哺乳
风险总结
关于在人乳汁中alirocumab的存在,对哺乳喂养婴儿的影响,或对乳汁生成的影响都没有资料。哺乳喂养的发育和健康获益应予母亲的PRALUENT临床需求和对哺乳喂养婴儿来自PRALUENT或来自母体所患情况任何潜在不良影响一起考虑。人IgG是存在人乳汁中,但发表数据提示哺乳乳汁IgG抗体不以实质上量进入新生儿和婴儿循环。
8.4 儿童使用
尚未确定在儿童患者安全性和疗效。
8.5 老年人使用
在对照研究中,1158例用PRALUENT治疗患者是≥65岁和241例用PRALUENT治疗患者是≥75 岁。这些受试者和较年轻受试者间未观察到安全性或有效性的总体差别,和其他临床经验报告没有确定老年和较年轻患者间反应中差别,但不能除外某些老年个体更大灵敏度。
8.6 肾受损
对有轻度或中度地受损肾功能患者无需剂量调整。不能得到严重肾受损患者数据。[见临床药理学(12.3).]
8.7 肝受损
对有轻度或中度肝受损患者无需剂量调整。不能得到严重肝受损患者数据。[见临床药理学(12.3).]
11 一般描述
Alirocumab是一种靶向前蛋白转化酶枯草溶菌素9(PCSK9)的人单克隆抗体(IgG1同工型)。Alirocumab是一种通过PCSK9的抑制剂通过重组DNA技术在中国仓鼠卵巢细胞悬浮培养中生产。Alirocumab由两个两个二硫键联的人重链组成,各自共价地通过二硫键连接至一个人kappa轻链。一个单一的N-连接的糖基化位点是位于在分子各个重链Fc恒定区的CH2结构域内。重和轻链的可变结构域形成抗体内PCSK9结合位点。Alirocumab有一个近似分子量146 kD。PRALUENT是一种无菌,无防腐剂,透明,无色至浅黄色溶液为皮下注射。PRALUENT 75 mg/mL或150 mg/mL溶液为皮下注射是在一个单剂量预装笔或单剂量预装注射器被供应在一个硅化的1 mL类型-1透明玻璃注射器。针护罩不用天然橡胶胶乳制成。
各个75 mg/mL预装笔或预装注射器含组氨酸(8 mM),聚山梨醇20(0.1 mg),蔗糖(100 mg),和注射用水USP,至 pH 6.0。各个150 mg/mL预装笔或预装注射器含组氨酸(6 mM),聚山梨醇20(0.1 mg),蔗糖(100 mg),和注射用水USP,至pH 6.0。
12 临床药理学
12.1 作用机制
Alirocumab是一种人单克隆抗体结合至前蛋白转化酶枯草溶菌素9型(PCSK9)。PCSK9结合至在肝细胞表面的低密度脂蛋白受体(LDLR)促进LDLR在肝内降解。LDLR是清除循环的LDL的主要受体,因此通过PCSK9导致LDL-C较高血水平LDLR水平减低。通过抑制前蛋白转化酶枯草溶菌素9[PCSK9]的结合至LDLR,alirocumab增加可得到的清除LDL的LDLRs数,从而降低LDL-C水平。
12.2 药效动力学
Alirocumab以一种浓度-依赖方式减低游离的前蛋白转化酶枯草溶菌素9型[PCSK9]。单次皮下给予alirocumab 75或150 mg后,游离PCSK9的最大抑制发生在4至8小时内。当alirocumab浓度减低低于定量低限,游离PCSK9浓度返回至基线浓度。
12.3 药代动力学
吸收
皮下(SC)给予5 mg至150 mg alirocumab后,至血清峰浓度中位时间(tmax)是3-7天。of after 单次SC给予75 mg至腹部,上臂,或大腿后alirocumab的药代动力学相似。通过群体药代动力学分析SC给药后alirocumab的绝对生物利用度是约85%。观察到略微大于剂量正比例,对一个2-倍增加剂量总alirocumab浓度有一个 2.1-至2.7-倍增加。在2至3剂后达到稳态有一个积蓄比值约2-倍。
分布
IV给药后,分布容积是约0.04至0.05 L/kg表明alirocumab是主要地分布在循环系统。
代谢和消除
未进行特异性代谢研究,因为alirocumab是一种蛋白。预期Alirocumab降解至小肽和个体氨基酸。在临床研究其中alirocumab是与阿托伐他汀[atorvastatin]或罗苏伐他汀[rosuvastatin]联用给予,在存在重复给予alirocumab 未观察到他汀类浓度相关变化,表明细胞色素P450酶(主要地CYP3A4和CYP2C9)和转运蛋白例如P-gp和OATP是不受alirocumab影响。
对alirocumab观察到两个消除相。在低浓度,消除是主要地通过与靶蛋白(PCSK9)饱和性结合,而在较高浓度alirocumab的消除是主要通过非饱和的蛋白水解通路。
根据群体药代动力学分析,在接受皮下alirocumab剂量75 mg Q2W或150 mg Q2W患者中在稳态时alirocumab的中位表观半衰期是17至20天。
特殊人群
进行一项来自2799例受试者数据群体药代动力学分析。被发现年龄,体重,性别,种族,和肌酐清除率不显著地影响alirocumab药代动力学。建议对这些人口统计指标无剂量调整。
儿童
在儿童患者中未曾研究PRALUENT[见特殊人群中使用(8.4)]。
肾受损
因为单克隆抗体已知不通过肾途径消除,预期肾功能不影响alirocumab的药代动力学。不能得到有严重肾受损患者数据。
肝受损
单次75 mg SC剂量给药后,在有轻度和中度肝受损受试者中alirocumab药代动力学图形与在有正常肝功能受试者相似。不能得到在有严重肝受损患者数据。
药物-药物相互作用
当给予一种他汀类alirocumab 的中位表观半衰期减低至12天;但是,这个差别没有临床意义和不影响给药建议。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未曾用alirocumab 进行致癌性研究。未曾进行alirocumab的致突变性评价;但是,预期单克隆抗体不改变DNA或染色体。
在性成熟猴皮下给药在5,15,和75 mg/kg/week,根据血清AUC皮下临床剂量150 mg每两周时全身暴露至103-倍的一项6个月慢性毒理学研究对生育力替代指标没有不良影响(如,动情周期性,睾丸体积,射精量,精子活动,或每次射精精子总计数)。此外,在大鼠或猴毒理学研究根据血清AUC与一个150 mg每两周剂量后临床全身暴露比较在全身暴露分别至11-倍和103-倍在6-个月研究,在生殖组织中没有alirocumab-相关解剖病理学或组织病理学不良发现。
13.2 动物毒理学和/或药理学
在成年猴一项13-周毒理学研究期间75 mg/kg每周1次alirocumab与40 mg/kg每天1次阿托伐他汀联用,根据AUC在大于最大推荐人用剂量150 mg每两周暴露的在暴露100-倍1至2个月后 PRALUENT对锁眼血蓝蛋白(KLH)体液免疫反应没有影响。
14 临床研究
在五项双盲安慰剂对照试验纳入3499例患者研究PRALUENT的疗效;36%是有杂合子家族性高胆固醇血症(HeFH)患者和54%是非-FH患者临床动脉粥样硬化心血管病。五项试验的三项试验是只在有HeFH患者中进行。所有患者正在接受一个他汀类最大地耐受剂量,有或无其他脂质修饰治疗。在纳入有HeFH患者试验中,或通过基因分型或临床标准(“定义FH” 利用或Simon Broome或WHO/Dutch脂质网络标准)做出HeFH的诊断。所有试验时间是至少52周与主要疗效终点测量在24周时(在LDL-C从基线变化均数百分率)。
三项研究用最初剂量75 mg每2周(Q2W)接着对对在8周时未实现他们预先确定目标LDL-C患者在12周基于标准向上滴定调整至150 mg Q2W。患者的大多数(57%至83%)被治疗共至少12 周不需要向上滴定调整。两项研究只使用一个150 mg Q2W剂量。
研究1是一项多中心,双盲,安慰剂-对照试验随机赋予1553例患者至PRALUENT 150 mg Q2W和788例患者至安慰剂。所有患者正在服用最大地耐受剂量的他汀类药物有或无其他脂质修饰治疗,和需要另外LDL-C减低。均数年龄为61岁(范围18-89),38%是妇女,93%为高加索人,3%为黑种人,和5%为西班牙/拉丁美洲人。总体,69%是非-FH患者有临床动脉粥样硬化心血管病和18%有HeFH。在基线时均数LDL-C是122 mg/dL。
用PRALUENT治疗患者中24周结束点前提早终止研究药物患者的比例是8%和用安慰剂治疗患者中8%。
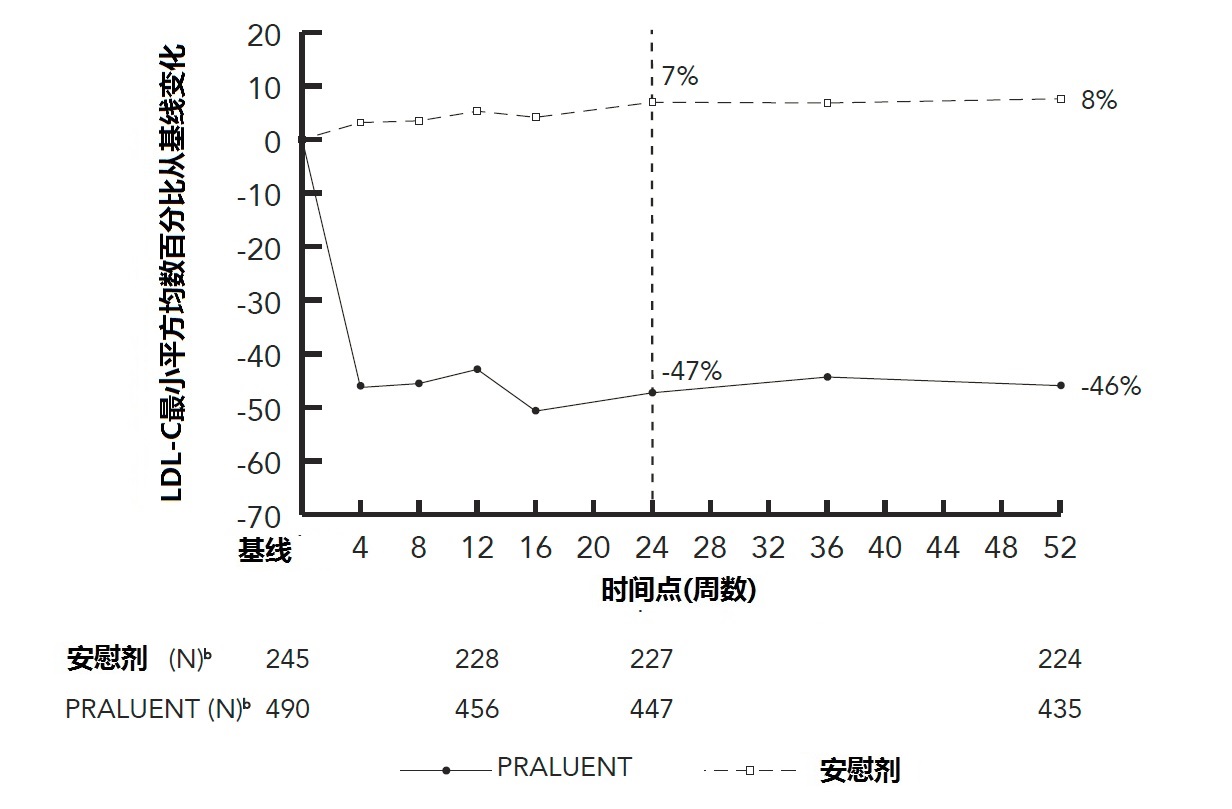
在周24时,P表2和图1。
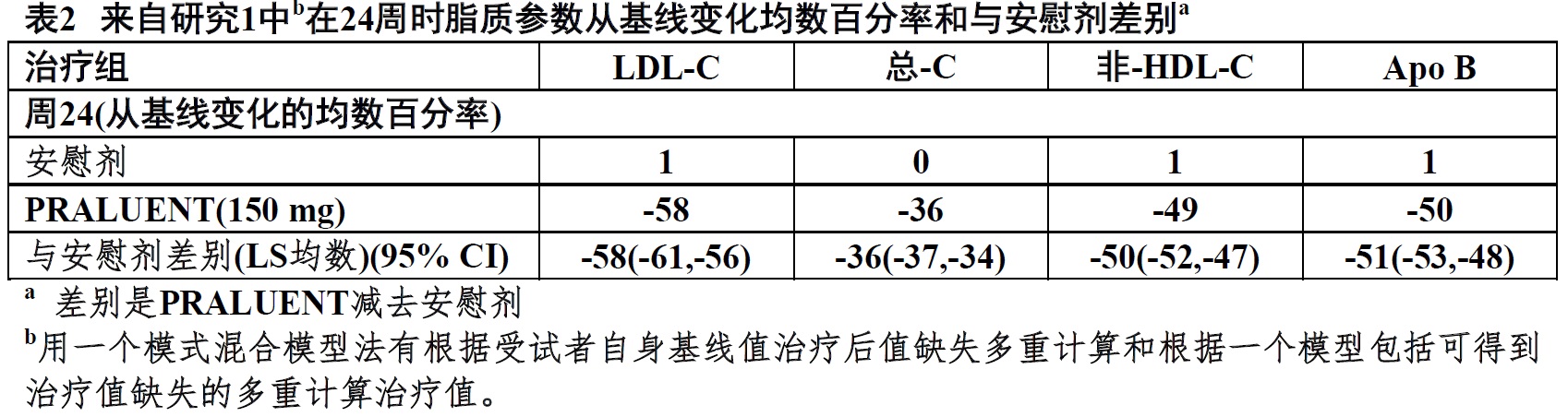
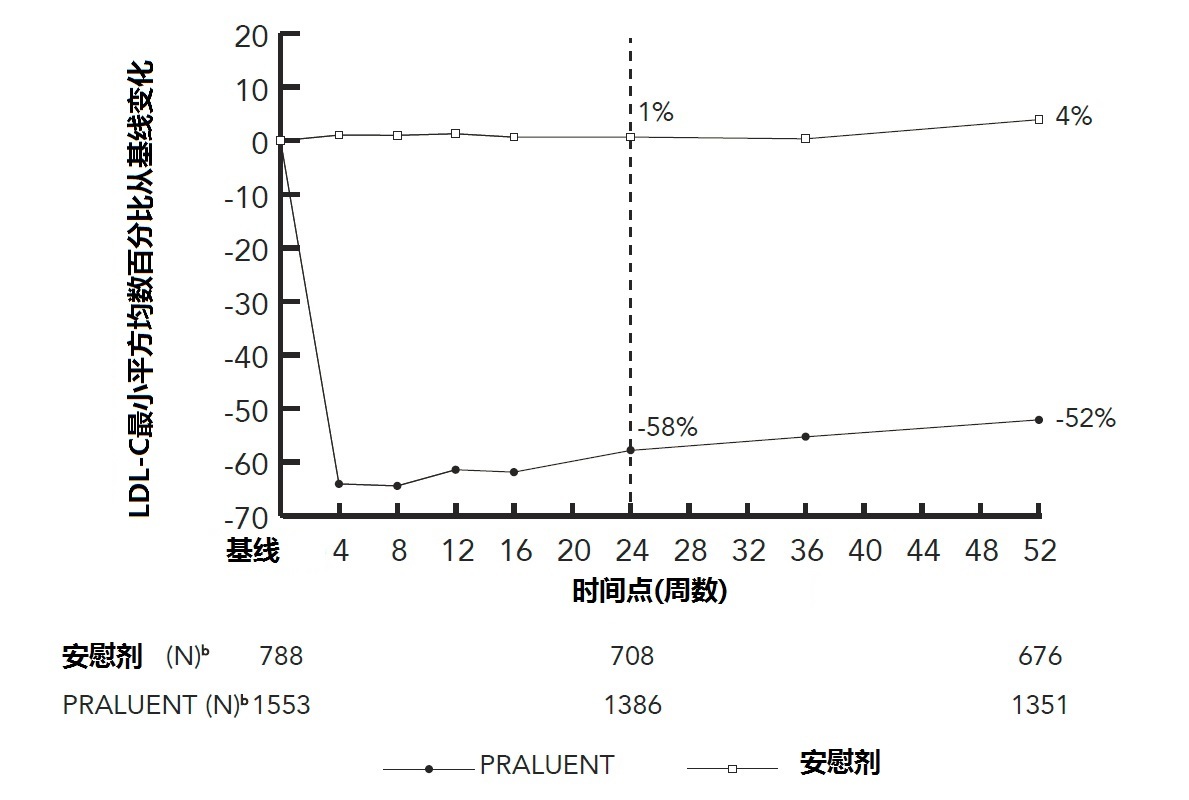
a 均数是根据所有随机化患者估算,有多重缺失数据计算考虑治疗依从性。b有观察数据患者数。
图1 在用最大地耐受他汀类治疗患者中用PRALUENT 150 mg Q2W和安慰剂Q2W跨越52周LDL-C从基线均数百分比变化(研究1)a
研究2是一项多中心,双盲,安慰剂-对照试验随机赋予209例患者至PRALUENT和107例至安慰剂。患者正在用最大地耐受剂量的他汀类药物有或无其他脂质修饰治疗,和需要另外 LDL-C减低。
平均年龄为63岁(范围39-87),34%是妇女,82%为高加索人,16%为黑种人,和11%为西班牙/拉丁美洲人。总体84%有临床动脉粥样硬化心血管病。均数基线LDL-C为102 mg/dL。
用PRALUENT治疗患者中24小时结束点前提早终止研究药物患者的比例是11%和用安慰见治疗患者中12%。
在周12时,用PRALUENT LDL-C从基线变化的均数百分率是-45%与之比较用安慰剂为1%,和PRALUENT75mg Q2W和安慰剂间LDL-C均数百分率变化治疗差别为-46%(95% CI:-53%,-39%)。
在周12时,如根据预先指定LDL-C标准需要另外LDL-C减低,对试验余下PRALUENT被向上滴定调整至150 mg Q2W。在周24时,用PRALUENTLDL-C从基线变化的均数百分率为-44%和用安慰剂-2%,和PRALUENT和安慰剂间LDL-C均数百分率变化治疗差别为-43%(95% CI:-50%,-35%; p-值:˂0.0001)。在32/191(17%)用PRALUENT治疗患者剂量被向上滴定调整至150 mg Q2W共至少12周。
研究3和4是多中心,双盲,安慰剂对照试验,组合,随机赋予490例患者至PRALUENT和245例至安慰剂。关于试验设计和合格性标准都相似。所有患者有HeFH,正在用一种最大地耐受剂量他汀类有或无其他脂质修饰治疗,和需要另外LDL-C减低。平均年龄为52岁(范围20-87),45%是妇女,94%为高加索人,1%为黑种人,和3%为西班牙/拉丁美洲人。总体,这些患者45% 有HeFH还有临床动脉粥样硬化心血管病。在基线时平均LDL-C为141 mg/dL。
考虑两项试验在一起,24小时结束点前提早终止研究药物患者的比例用PRALUENT治疗患者中是6%和用安慰见治疗患者中4%。
在周12时,PRALUENT 75 mg Q2W和安慰剂间LDL-C均数百分率变化治疗差别为-48%(95% CI:-52%,-44%)。
在周12时,如根据预先指定LDL-C标准需要另外LDL-C降低,对余下实验吗PRALUENT被向上滴定调整至150 mg Q2W。在24周时, PRALUENT和安慰剂间在均数LDL-C百分率从基线变化的均数治疗差别是-54%(95% CI:-59%,-50%; p-值:˂0.0001)。在196/469(42%)用PRALUENT治疗患者这个剂量被向上滴定调整至150 mg Q2W共至少12周。LDL-C-降低影响是持续至周52。
对另外结果见表3和图2。
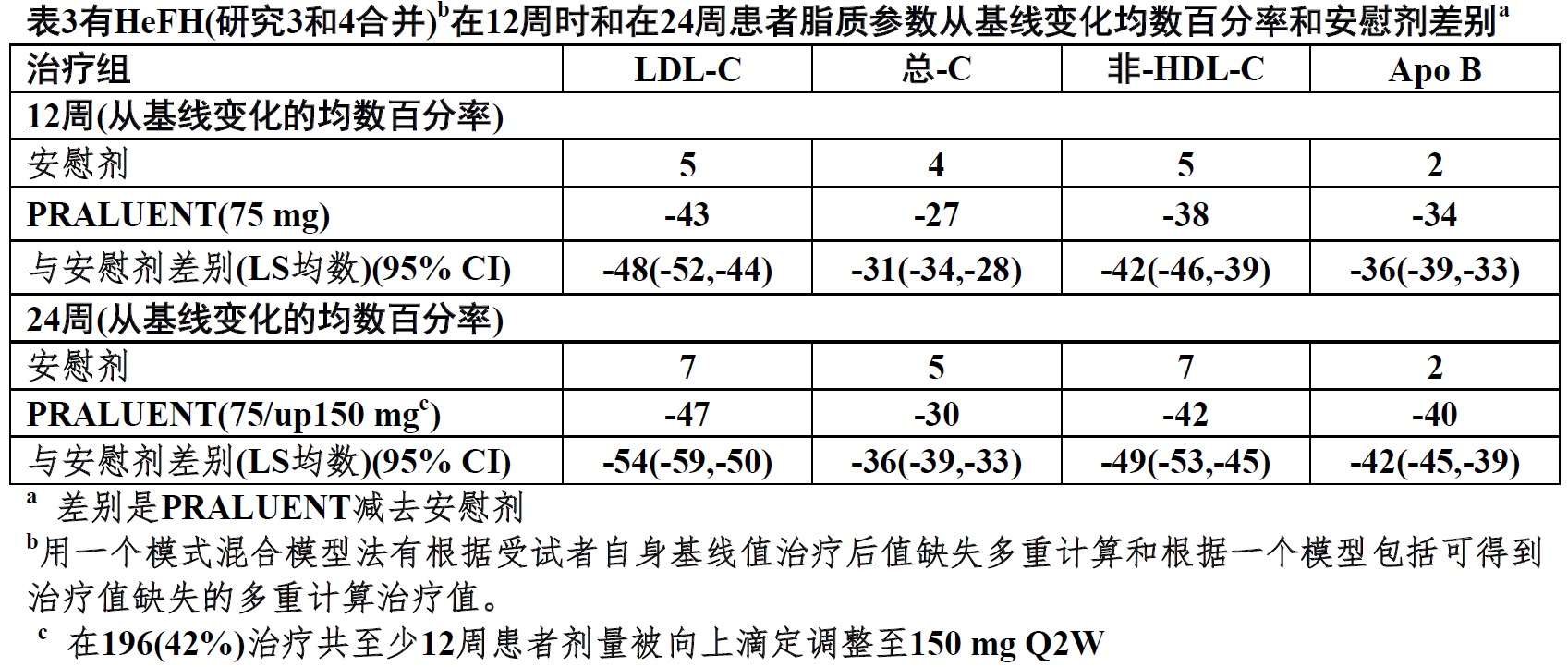
a 均数是根据所有随机化患者估算,有多重缺失数据计算考虑到治疗的依从性。b有观察数据患者数。
图2在有HeFH对最大地-耐受他汀类治疗患者用PRALUENT 75/150 mg Q2W和安慰剂Q2W LDL-C跨越52周从基线均数百分比变化(研究3和4合并)a
研究5是一项多中心,双盲,安慰剂-对照试验随机赋予72例患者至PRALUENT 150 mg Q2W和35例患者至安慰剂。患者有HeFH与一个基线 LDL-C ≥160 mg/dL同时用最大地耐受剂量的他汀类有或无其他脂质修饰治疗。平均年龄为51岁(范围18-80),47%是妇女,88%为高加索人,2%为黑种人,和6%为西班牙/拉丁美洲人。总体,50%有临床动脉粥样硬化心血管病。在基线时平均LDL-C为198 mg/dL。
在24-周结束点前终止研究药物患者的比例用PRALUENT治疗患者中为10%和用安慰见治疗患者中0%。
在周24时,用PRALUENTLDL-C从基线变化的均数百分率为-43%和用安慰剂-7%,和PRALUENT和安慰剂间均数LDL-C百分率变化治疗差别为-36%(95% CI:-49%,-24%; p-值:˂0.0001)。
16 如何供应/贮存和处置
PRALUENT是一种透明,无色至浅黄溶液,supplied在单剂量预装笔和单剂量预装玻璃注射器中供应。PRALUENT的每支预装笔或预装注射器被设计成输送1 mL的75 mg/mL或150 mg/mL 溶液。
可得到PRALUENT在纸盒中含1或2,预装笔和1或2,预装注射器。
贮藏在冰箱在36°F至46°F(2°C至8°C)为了避光保护在外纸盒中。
不要冻结。不要暴露于极热。不要摇动。.
17 患者咨询资料
见FDA-批准的患者说明书(患者资料和使用指导)。
过敏反应
● 忠告患者如发生严重过敏反应任何体征和症状终止PRALUENT和及时寻求医学关注。
对给药指导
●指导患者和护理人员在患者开始使用PRALUENT前阅读患者资料和使用指导(IFU),和每次 患者得到一次再充填因为可能有他们需要知道的新资料。
●对患者和护理人员提供适当皮下注射技术指导,包括无菌术,和如何正确地使用预装笔或预装注射器(见使用指导页单)。告知患者注射PRALUENT可能花费至 20秒。
●用前预装笔或预装注射器应被允许加温室温共30至40分钟。在加温后应尽可能立即使用PRALUENT。在77°F(25°C)超时制冷不要超过24小时。
●应该提醒患者和护理人员应预装笔或预装注射器必须不再次使用和指导适当笔和注射器遗弃在防穿刺容器的技术。不回收容器。

