批准日期: 2015年10月23日;公司: Alexion Pharmaceuticals公司
FDA的药品评价和研究中心中药物评价III室副主任说:“这是首次,HPP社会经得到一种被对这种罕见病的批准治疗,” “Strensiq的批准是一个实例表明突破性治疗指定程序如何能为有罕见病人们带来新和需要的治疗。”突破性治疗指定,孤儿药物指定,优先审评,罕见儿童疾病优先审评凭证。
http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/125513s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用STRENSIQ所需所有资料。请参阅STRENSIQ完整处方资料。
STRENSIQ™(asfotase α)注射液,为皮下使用
美国初次批准: Pending
适应证和用途
STRENSIQ™是一种组织非特异性碱性磷酸酶适用为有围产期/婴儿-和青少年-发病低磷酸酯酶(HPP)患者的治疗。(1)
剂量和给药方法
围产期/婴儿-发病HPP(2.1)
⑴ 推荐剂量方案是2 mg/kg皮下给药每周3次,或1 mg/kg每周给药6次。注射部位反应可能限于每周6次方案的耐受度。
⑵ 对疗效不足剂量可被增加至每周三次3 mg/kg。
青少年-发病HPP(2.2)
⑶ 推荐剂量方案是2 mg/kg皮下给药每周3次,或1 mg/kg每周给药6次。注射部位反应可能限于每周6次方案耐受度。
制备和基于体重给药(2.3):
⑷ 谨慎: 在体重低于40 kg儿童患者不要使用80 mg/0.8 mL小瓶因为用80 mg/0.8 mL小瓶(较高浓度)达到asfotase α的全身暴露是较低与用其他规格小瓶(较低浓度)实现暴露。对这个亚组患者一个较低暴露可能不适当。
⑸ 对按治疗方案基于体重给药表见完整处方资料。
给药(2.4):
⑹ 只为皮下注射.
⑺ 轮转注射部位。不要给药至发红,发炎或肿胀区域。
剂型和规格
注射液: 一次性使用小瓶18 mg/0.45 mL,28 mg/0.7 mL,40 mg/mL,或80 mg/0.8 mL溶液。(3)
禁忌证
无。(4)
警告和注意事项
⑴ 超敏性反应: 监视和如发生严重反应,终止治疗和开始适当药物治疗。(5.1)
⑵ 脂肪代谢障碍: 适当注射技术和轮转注射部位后治疗后几个月被报道局部反应。(5.2)
⑶ 异位性钙化(眼和肾): 在基线时和治疗期间定期用眼科检查和肾超声监视。(5.3)
不良反应
最常见不良反应(≥ 10%)是注射部位反应,脂肪代谢障碍,异位性钙化和超敏性反应。(6.1)
报告怀疑不良反应,联系Alexion制药公司电话1-844-259-6783或FDA电话1-800-FDA-1088或www.fda.gov/medwatch
完整处方资料
1 适应证和用途
STRENSIQ™是适用为有围产期/婴儿-和青少年-发病低磷酸酯酶(HPP)患者的治疗。
2 剂量和给药方法
2.1 对围产期/婴儿-发病HPP剂量
对围产期/婴儿-发病HPP的治疗STRENSIQ推荐剂量方案是6 mg/kg每周皮下给药如下任一:
● 2 mg/kg每周3次,或
● 1 mg/kg每周6次。注射部位反应可能限于每周6次方案的耐受度[见不良反应(6.1)]。
对缺乏疗效STRENSIQ的剂量可增加(如,呼吸状态,生长,或放射影像发现无改善)直至9 mg/kg每周皮下给予如3 mg/kg每周三次。
2.2 对青少年-发病HPP剂量
对青少年-发病HPP的治疗STRENSIQ推荐剂量方案是6 mg/kg每周皮下给药如以下任一:
● 2 mg/kg每周三次,或
● 1 mg/kg每周6次。注射部位反应可能限于每周6次方案的耐受度[见不良反应(6.1)]。因为用80 mg/0.8 mL小瓶(较高浓度)实现的asfotase α全身暴露是较低于用其他强度小瓶(较低浓度)所实现的全身暴露。对这个亚组患者一个较低暴露可能不适当[见剂型和规格(3),临床药理学(12.3)]。
1. 根据患者的体重和推荐剂量确定对处方剂量所需的体积。遵循以下步骤确定患者剂量。
总剂量(mg) = 患者的体重(kg) × 处方剂量(mg/kg)
总注射体积(mL) = 总剂量(mg)处以浓度(40 mg/mL或80 mg/0.8 mL)
小瓶总数 = 总注射体积除以小瓶体积(mL)
2. 确定每周注射的频数。
3. 确定剂量。在确定剂量时患者体重应取整数至最近的公斤(kg)数。使用以下为指导提供的表,对给予2 mg/kg每周三次的患者(表1),注射体积除以小瓶体积(mL)
1 mg/kg每周6次(表2)和为剂量递增至3 mg/kg每周3次,建议只对有围产期/婴儿-发病HPP患者[见剂量和给药方法(2.1)](表3)。
4. 当制备一个为注射大于1 mL的体积,将体积等分为两个注射器间,和给予2次注射。当给予两次注射时,使用两个分开的注射部位。
5. 观察在小瓶中溶液有无颗粒物质和变色。STRENSIQ以清澈,略微乳白色或乳白色,无色至略微黄色水溶液;可能存在少许透明或白色颗粒。遗弃任何与此外观不一致任何小瓶。
6. 组装注射供应。用无菌可遗弃1 mL注射器给予STRENSIQ和½英寸注射针头,建议25至29号。对于剂量大于,注射体积应被等同地分开至2个1 mL注射器间。总是使用新注射器和针。.
7. 取下小瓶帽,无菌地制备小瓶和将注射器插入小瓶为给药抽吸处方剂量。.
8. 去掉注射器内任何空气泡和证实正确剂量。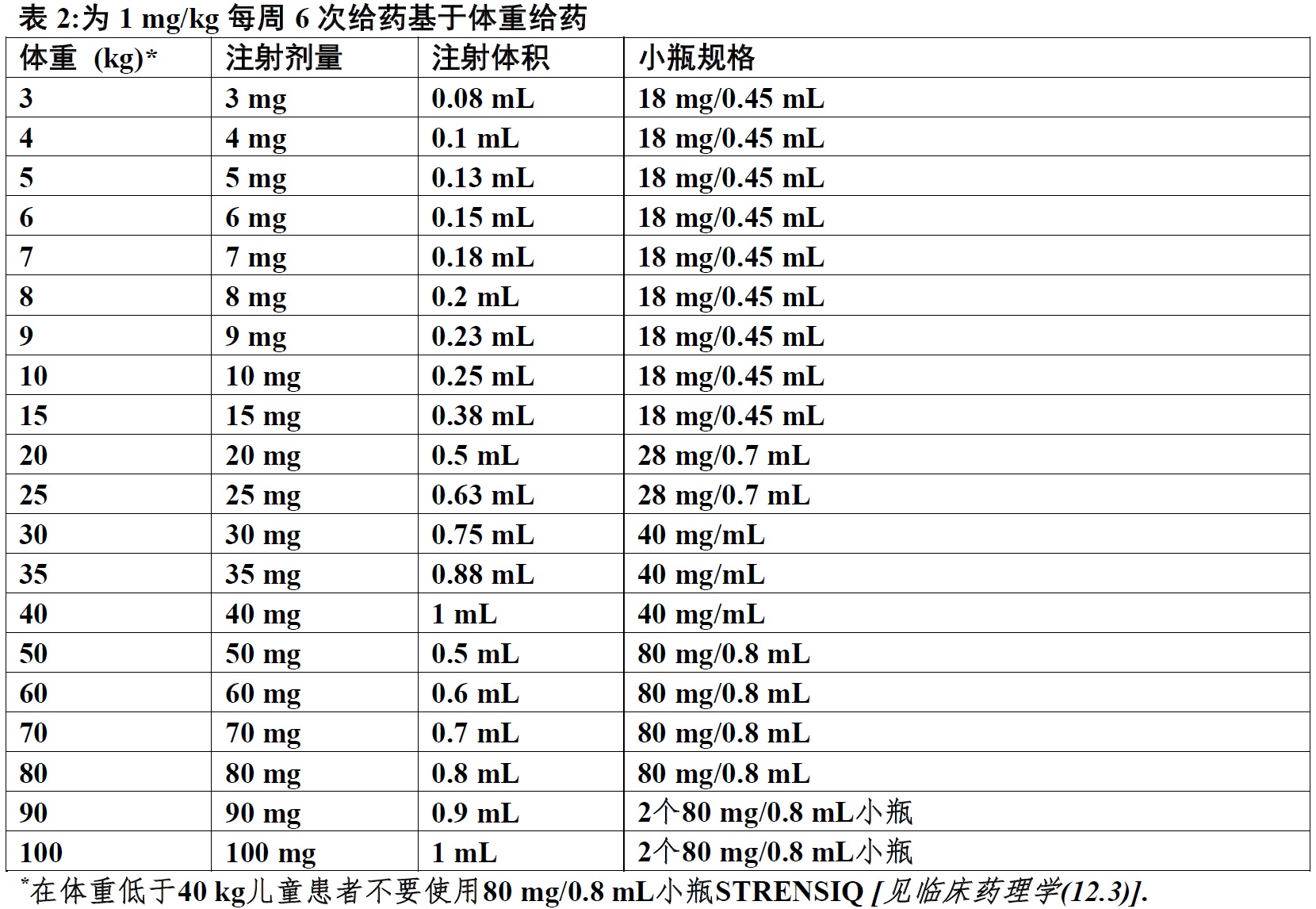

2.4 给药
STRENSIQ是只为皮下注射。
1. 在从冰箱取出小瓶1小时内给予STRENSIQ。
2. 在以下轮转部位注射以减少脂肪代谢障碍风险:腹部区域,腿,或三角肌[见警告和注意事项(5.2),不良反应(6.1)]。
3. 不要给予注射至发红,发炎或肿胀的区域。
4. 皮下注射STRENSIQ至确定部位和适当地遗弃针头。
5. STRENSIQ小瓶是只为一次性使用。遗弃任何未使用产品。
3 剂型和规格
STRENSIQ以无菌,无防腐剂,无热原,清澈,略微乳白色或乳白,无色至略微黄水溶液供应;可能存在少许小半透明或白色颗粒。产品可得到为:
注射液: 在一次使用小瓶18 mg/0.45 mL,28 mg/0.7 mL,40 mg/mL,或80 mg/0.8 mL溶液。
4 禁忌证
无。
5 警告和注意事项
5.1 超敏性反应
STRENSIQ-治疗患者曾报道超敏性反应。在临床试验中,用STRENSIQ治疗患者1/99(1%)经受与过敏反应一致体征和症状,包括呼吸困难,恶心,眼周水肿,和眩晕。在这个患者中,在3.5岁的情况中反应发生STRENSIQ注射后接近1分钟正在进行STRENSIQ治疗和无医疗处理解决。患者恢复STRENSIQ治疗和接受苯海拉明[diphenhydra最小e]预先用药共未指定时间和随后无预先药物继续STRENSIQ治疗。STRENSIQ-治疗患者还曽报道其他超敏性反应,包括呕吐,发热,头痛,潮红,烦躁,畏寒,皮肤红斑,皮疹,瘙痒和口腔感觉减退[见不良反应(6.1)]。
如发生严重超敏反应,终止STRENSIQ治疗和开始适当药物治疗。STRENSIQ再给予严重反应后个体患者考虑风险和获益。如做出决定在给予产品,监视患者严重超敏性反应的体征和症状再次出现。
5.2 脂肪代谢障碍
在临床试验中在用TRENSIQ治疗患者中曾报道几个月后在注射部位局部化脂肪代谢障碍,包括脂肪萎缩和脂肪增生[见不良反应(6.1)]。忠告患者遵循适当注射技术和轮转注射部位[见剂量和给药方法(2.4)]。
5.3 异位性钙化
有HPP患者是处在发展异位性钙化风险增加。在临床试验中用STRENSIQ,报道14病例(14%)眼的异位钙化包括角膜和结膜,和肾(肾钙化)。信息不足以确定报道时间是否与疾病一致或由于STRENSIQ。没有报道的视力变化或肾功能变化来自异位性钙化的结果。
建议在基线时和肾超声和用STRENSIQ治疗期间定期眼科检查以监视眼和肾异位性钙化的体征和症状和对视力或肾功能中变化。
6 不良反应
说明书中其他处描述以下不良反应:
● 超敏性反应[见警告和注意事项(5.1)]
● 脂肪代谢障碍[见警告和注意事项(5.2)]
● 异位性钙化[见警告和注意事项(5.3)]
6.1 临床研究经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
下面描述数据反映对STRENSIQ暴露在99例患者有围产期/婴儿-或青少年-发病HPP(年龄1天至58岁[注原文如此])用STRENSIQ治疗,大多数共超过2年(范围1天至312周[78个月]): 51例患者接受至少96周(24个月)治疗和39例患者接受168周(42个月)或更长治疗。
常见不良反应
总之,报道的最常见不良反应是注射部位反应(63%)。其他常见不良反应包括脂肪代谢障碍(28%),异位性钙化(14%),和超敏性反应(12%)。
表4 总结在临床试验中皮下注射STRENSIQ后按患者群和STRENSIQ给药方案发生率至少10%的不良反应。
青少年-发病HPP患者当与围产期/婴儿-发病HPP患者比较,注射部位反应,脂肪代谢障碍和异位钙化的频数是较高。
注射部位反应的多数在一周解决。两例患者经受注射部位反应导致减低他们的STRENSIQ 剂量。一例患者因为注射部位反应结果从每周6次给药转至每周3次给药。其他一例患者经受一个注射部位变色严重注射部位反应和从试验撤出。

较不常见不良反应
发生率低于1%的不良反应包括:
● 低钙血症
● 肾结石
● 慢性肝炎
● 维生素B6减低
6.2 免疫原性
如同所有治疗性蛋白,有免疫原性潜能。临床试验期间,接受用STRENSIQ治疗患者用一种电化学发光(ECL)免疫分析曽被检测到抗-药抗体。被测试抗体阳性样品根据STRENSIQ体外催化活性的抑制作用确定中和抗体的存在。被纳入临床试验中98例有低磷酸酯酶(HPP)和有基线后抗体数据患者,在接受STRENSIQ治疗后有些时间点76(78%)对抗-药抗体测试阳性。那些76例患者中,34(45%)还显示存在中和抗体。观察到抗-药抗体滴度和中和抗体(抑制%)值间无相关。抗-药抗体的形成导致asfotase α的全身暴露减低。[见临床药理学(12.3)].
抗体形成的检测是依赖于分析的灵敏度和特异性。此外,在一个分析中观察到抗体阳性的发生率(包括中和抗体)可能受几种因子影响包括分析方法学,样品处置,采样时间,同时用药,和所患疾病。因为这些理由,比较对STRENSIQ抗体的发生率与抗体对其他产品的发生率可能是误导。
8 特殊人群中使用
8.1 妊娠
风险总结
对STRENSIQ在妊娠妇女使用没有可得到的人数据告知药物相关风险。动物生殖研究,在器官形成期asfotase α静脉给予至妊娠大鼠和兔在剂量致血浆暴露至人推荐剂量时人暴露分别21和24倍显示无胎儿毒性,胚胎致死性或致畸胎性[见数据]。
在美国一般人群,主要出生缺陷和临床上认可妊娠中流产的估算背景风险分别为2至4%和15 至20%。
数据
动物数据
在器官形成期时给予Asfotase α至大鼠(从妊娠第6天至产后第19天)和兔(在妊娠第7至19天)在静脉剂量至50 mg/kg/day,接近对一例50 kg个体每周3次给予2 mg/kg剂量时人AUC 65486 ng.h/mL分别21和24倍,对胚胎胎儿发育没有致任何不良影响。在妊娠大鼠一项新生鼠前和后发育研究显示在静脉剂量(从妊娠第6天至产后第19天)的asfotase α至50 mg/kg/day接近对一例50 kg个体每周3次给予2 mg/kg剂量人AUC 65486 ng.h/mL的21倍时对新生鼠前和后发育无不良影响的证据。
8.2 哺乳
风险总结
没有在人乳汁中存在asfotase α,对哺乳喂养婴儿影响,或对乳汁生产影响的数据。哺乳喂养的发育和健康获益应与母亲对STRENSIQ临床需求和哺乳喂养婴儿来自asfotase α或来自所患母体情况任何潜在不良影响一并考虑。
8.4 儿童使用
STRENSIQ在儿童患者的安全性和疗效已被确定。STRENSIQ的使用是根据4项前瞻性,在99例有围产期/婴儿-发病或青少年-发病HPP成年和儿童患者进行开放临床试验。患者多数是1天至16 岁(89/99 [90%])儿童患者[见临床研究(14)]。
8.5 老年人使用
在STRENSIQ临床试验中没有纳入年龄65岁有围产期/婴儿-或青少年-发病HPP患者。因此,没有可得到的信息确定年龄65岁和以上患者反应是否不同与较年轻患者。
11 一般描述
STRENSIQ是asfotase α的制剂,它是一种两个相同的多肽链组成可溶性糖蛋白。每条链含726 个氨基酸有理论质量161 kDa。每链由人组织非-特异性碱性磷酸酶(TNSALP)的催化结构域,人免疫球蛋白G1 Fc结构域和一个德卡-天冬氨酸肽[deca-aspartate peptide]被用作为骨靶向结构域组成。两条多肽链是通过两个二硫键共价地连接组成。
STRENSIQ是一种组织非特异性碱性磷酸酶通过重组DNA技术在一个中国仓鼠卵巢细胞系生产。TNSALP是一种金属-酶催化磷酸单酯的水解与释放无机磷酸盐和乙醇。Asfotase α有一个比活性620至1250 units/mg。一个活性单位被定义为在37°C,每分钟从pNPP形成1 μmol的对硝基苯酚所需要的asfotase α量。
STRENSIQ(asfotase α)是一个无菌,无防腐剂,无热原,清澈,略微乳白或乳白,无色至略微黄色,有少许半透明或白色颗粒,水性溶液为皮下给药。STRENSIQ在一次性玻璃小瓶中供应,内含asfotase α; 磷酸氢二钠,七水合物; 磷酸二氢钠,一水合物;和氯化钠在一个pH值在7.2 和7.6间。表5描述STRENSIQ小瓶内容的介绍。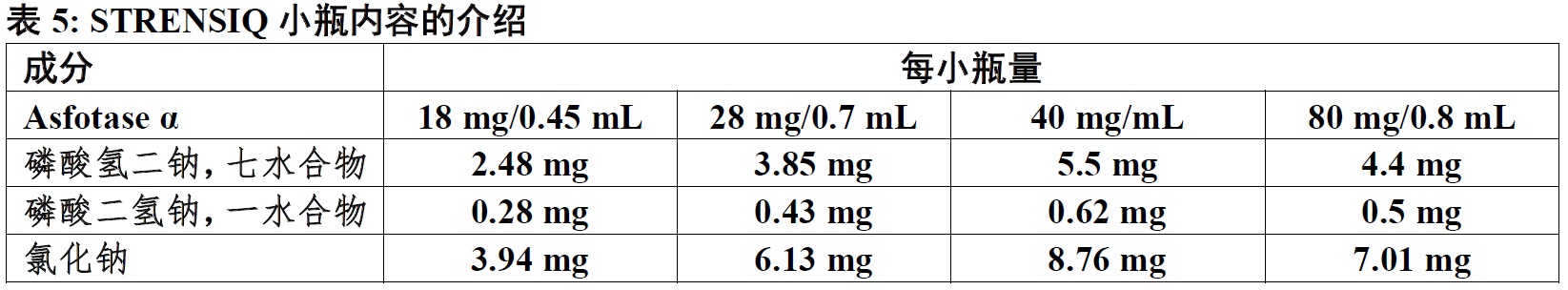
12 临床药理学
12.1 作用机制
HPP是被TNSALP酶活性中缺乏所致,它导致几种TNSALP[tissue non-specific alkaline phosphatase]底物水平升高,包括无机焦磷酸盐(PPi)。细胞外PPi水平升高阻断羟基磷灰石晶体生长它抑制骨矿物质化和导致未矿化骨基质的累积它表现为婴幼儿和儿童佝偻病和一旦生长板关闭骨骼变形和如骨软化症(骨软化),伴随着肌肉无力。用STRENSIQ治疗的替代减低酶底物水平。
12.2 药效动力学
围产期/婴儿-和青少年-发病HPP用STRENSIQ治疗患者治疗的6至12周内血浆中TNSALP底物,PPi和吡哆醛5’-磷酸(PLP)减低。血浆PPi和PLP水平减低与临床结局不相关。
来自围产期/婴儿-发病和青少年-发病HPP用STRENSIQ治疗患者骨活检数据证实骨质体积和厚度减低表明骨矿物质化改进。
12.3 药代动力学
根据在38例HPP患者数据,跨越剂量范围0.3 mg/kg至3 mg/kg,asfotase α的药代动力学表现为剂量正比例性和表现与时间-无关。早在给予首次剂量后三周实现稳态暴露。皮下给药后末端半衰期约为5天。
表6总结20例HPP患者皮下多次剂量给予STRENSIQ在2 mg/kg每周3次后药代动力学参数;研究2中(年龄低于或等于5岁)和研究3(年龄大于5至12岁),表明两个年龄组患者间药代动力学相似。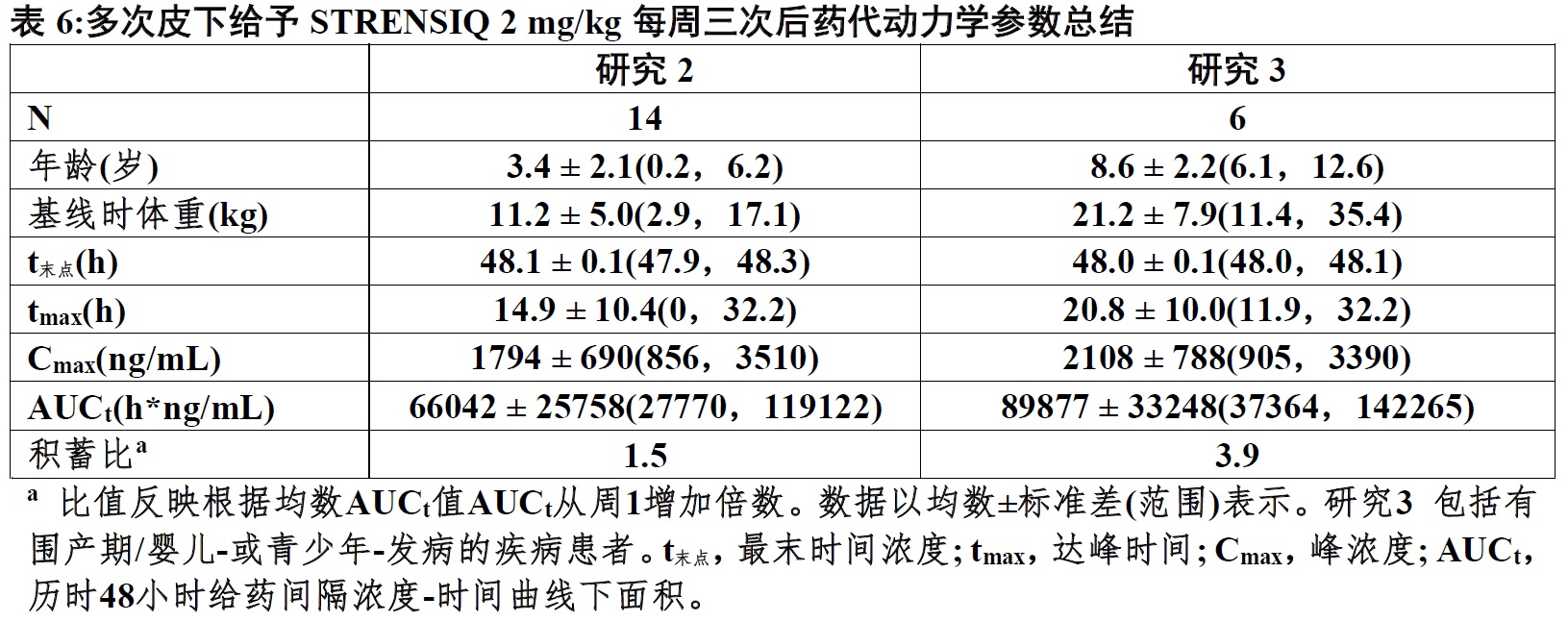
Asfotase α浓度的群体PK分析支持基于体重给药因为体重是asfotase α清除的主要协变量。在HPP患者中制剂浓度对asfotase α全身暴露有影响。在相同剂量的STRENSIQ,较高浓度制剂(80 mg/0.8 mL小瓶)与较低浓度制剂比较(18 mg/0.45 mL,28 mg/0.7 mL或40 mg/mL小瓶)达到实现接近25%较低全身asfotase α暴露(即,浓度和AUC)[见剂量和给药方法(2.1)]。
抗-药抗体的形成导致asfotase α的全身暴露减低。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
未曾在动物中用asfotase α进行长期研究评价致癌性潜能或研究评价致突变性潜能。妊娠大鼠中每天静脉给予Asfotase α在剂量直至50 mg/kg/day(接近人50 kg个体每周3次给予2 mg/kg剂量人AUC 65486 ng.h/mL的21倍)被发现对雄性和雌性大鼠生育力和生殖行为无不良影响。
14 临床研究
14.1 围产期/婴儿-发病HPP
研究1是一项在11例患者24-周前瞻性单-臂试验,7/11(64%)是女性和10/11(91%)是白种人,年龄3周至39.5个月有严重围产期/婴儿-发病HPP。严重围产期/婴儿-发病HPP被定义为HPP的生化,医疗病史和放射影像证据以及存在下列任一: 佝偻病的胸畸形,维生素B6-依赖性癫痫发作,或不能茁壮成长。10/11例者完成24-周试验和在延伸期继续治疗。9例患者曾被治疗共至少216周(54个月)和4例者曾被治疗共超过240周(60个月)。接受STRENSIQ患者对第一个月每周在3 mg/kg;随后,剂量增加至每周9 mg/kg被允许对体重和/或对缺乏疗效改变剂量。所有10患者需要剂量增加至每周6 mg/kg或更高;9例患者开始治疗后4和24周间增加和1例患者70周后由于次优临床反应增加。一例患者根据PK数据剂量从每周9 mg/kg减低至每周6 mg/kg。
研究2是在59例患者一项前瞻性开放研究,32/59(54%)是女性和46/59(78%)为白种人,年龄1 天至78个月有围产期/婴儿-发病HPP。患者接受STRENSIQ在每周6 mg/kg共头4周。10例患者由于次优临床反应接受剂量增加较高于每周6 mg/kg,开始治疗后8和24周间有剂量增加。对围产期/婴儿发病HPP治疗STRENSIQT的推荐剂量方案是直至每周9 mg/kg皮下给予如3 mg/kg 每周3次[见剂量和给药方法(2.1)]。
41例患者曾被治疗共至少24周(6个月)和15例患者曾被治疗共至少96周(24个月)。
生存和无通气生存期
在STRENSIQ-治疗患者(研究1和2)有相似临床特征未治疗患者历史队列比较生存和无有创通气生存期(表7和图1)。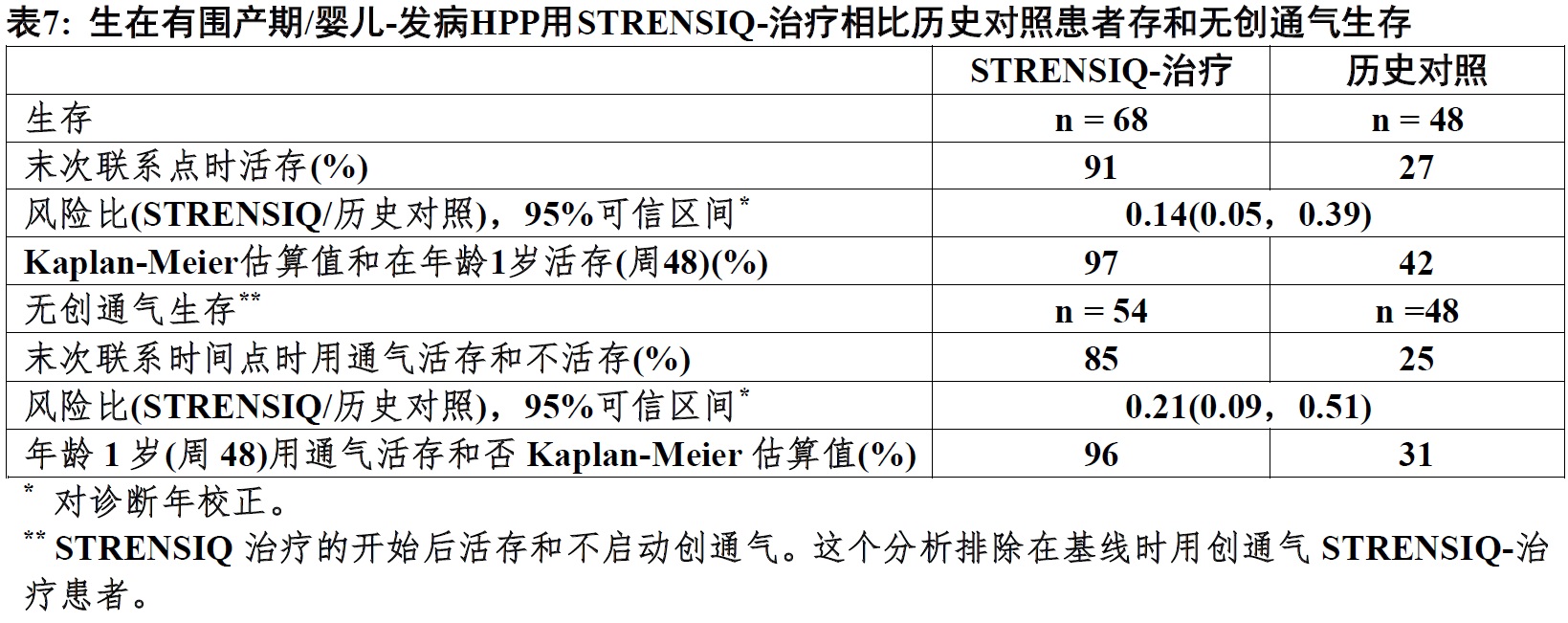
在需要任何形式呼吸支持患者,21/26例(81%)被治疗患者生存通过他们的最后评估(最后评估时中位年龄为3.2岁),相比较历史对照为1/20例(5%)。
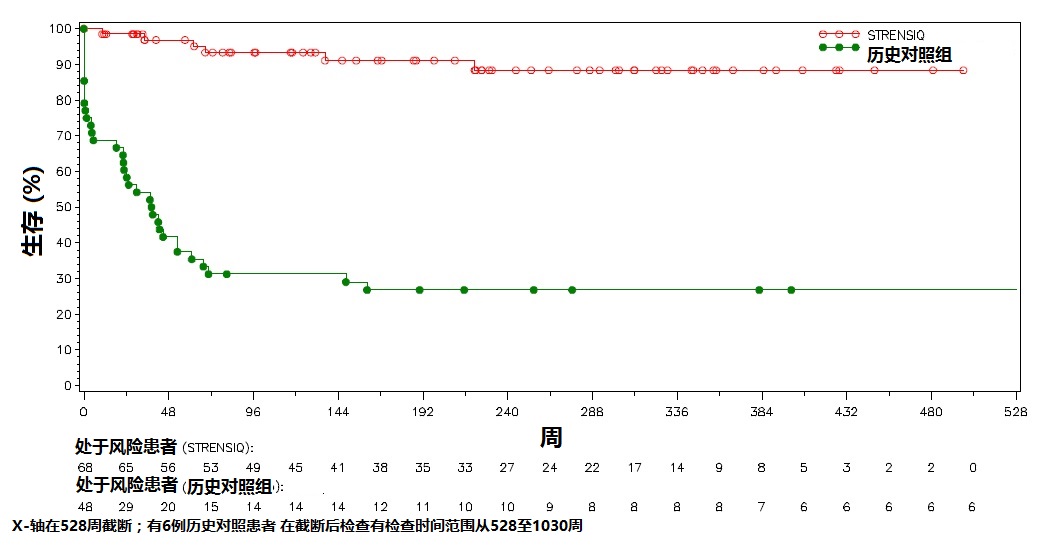
图1:有围产期/婴儿-发病HPP患者STRENSIQ-治疗相比历史对照的总体生存
骨骼表现
放射影像来自68例STRENSIQ-治疗围产期/婴儿-发病HPP患者,包括在研究1和264例患者,和研究3中4例患者[见临床研究(14.2)],被检查以利用7-点放射影像变化全面印象(RGI-C)评分评估HPP-相关佝偻病。有最小RGI-C评分+2患者被定义为“反应者”。在24个月;在最后评估可见到改善,50/68例[74%]被治疗患者被计为RGI-C反应者。从历史对照不能得到对比数据。基线和最末次RGI-C评估间时间间隔为24个月(范围是1个月至67个月)。
18例围产期/婴儿-发病HPP患者治疗过程期间经受骨折。材料不充分不能确定STRENSIQ对骨折的影响。
生长
可得到对72例围产期/婴儿-发病HPP患者,包括68例患者纳入在研究1和2,和纳入研究3的4例患者治疗后身高和体重测量(如通过z-评分测定)(表8)。
14.2 青少年-发病HPP
研究3是一项前瞻性开放24-周试验包括8例青少年-发病HPP患者和5例围产期/婴儿-发病HPP患者,11/13(85%)
为男性和12/13(92%)为白种人[见临床研究(14.1)]; 纳入时,患者为6至12岁。所有8例青少年-发病患者进入延伸研究和被治疗共至少48个月。所有试验纳入,患者被随机化接受STRENSIQ在每周6 mg/kg或9 mg/kg。2例患者在主要治疗期接受剂量减低,包括1例患者经受维生素B6水平减低和1例患者经受复发性注射部位反应。延伸期时,对所有患者给药方案为初始地改变至每周3 mg/kg。给药随后增加至每周6 mg/kg,没有患者需要较高与每周6 mg/kg剂量。为青少年-发病HPP治疗STRENSIQ的推荐给药方案是每周6 mg/kg[见剂量和给药方法(2.1)]。
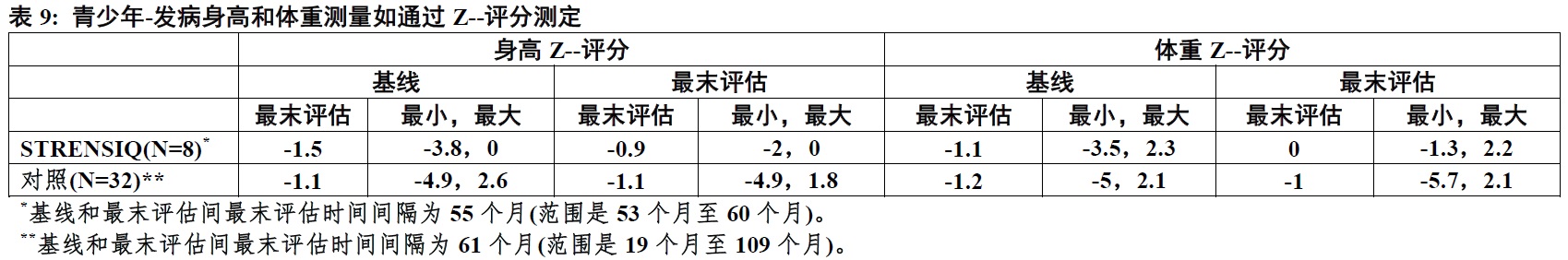
生长
在8例STRENSIQ-治疗患者身高和体重测量(如通过z-评分测定)是与32例有相似临床特征的未治疗患者历史队列比较(表9)。对历史患者身高和体重数据是从病历收集。
骨骼表现
来自8例STRENSIQ-治疗患者和32例历史对照的X光片被比较用7-点放射影像变化全面印象评分RGI-C评估HPP-相关佝偻病。患者实现RGI-C评分2或更高(相应于佝偻病的实质上愈合) 被分类为对治疗反应者。治疗的54个月时所有8例被治疗患者被计为反应者。对对照患者基线和末次RGI-C评估间最末评估时间是56个月(范围为8至95个月)。最末评估时,2/32例(6%)对照患者被计为反应者。
治疗过程时有青少年-发病HPP的8/20例(40%)患者经受新骨折。对评估STRENSIQ对骨折的影响数据不充分。
步态/移动能力
在8例 STRENSIQ-治疗患者在6个月间隔至36个月用一个经修饰的面向移动能力性能评估-步态(MPOMA-G)评分)评估步态。在7/8例患者还用6分钟走路测试(6MWT)评估移动能力。在6/8例患者任何一脚步长至少改善1点与之比较对照患者为1/6例(17%)。有6MWT预测百分率值对年龄,性别,和身高-匹配同龄人正常范围内患者的比例,从在基线时0/8例患者在48个月时增加至6/6例患者(100%)和在这个时间点所有6例还能比基线走较长距离。
16 如何供应/贮存和处置
STRENSIQ被供应为无菌,无热原,无防腐剂,清澈,略微乳白或乳白,无色至略微黄水性溶液;可能存在少许小半透明或白颗粒。可得到产品为一次用小瓶在1个或12个小瓶的纸盒以以下规格: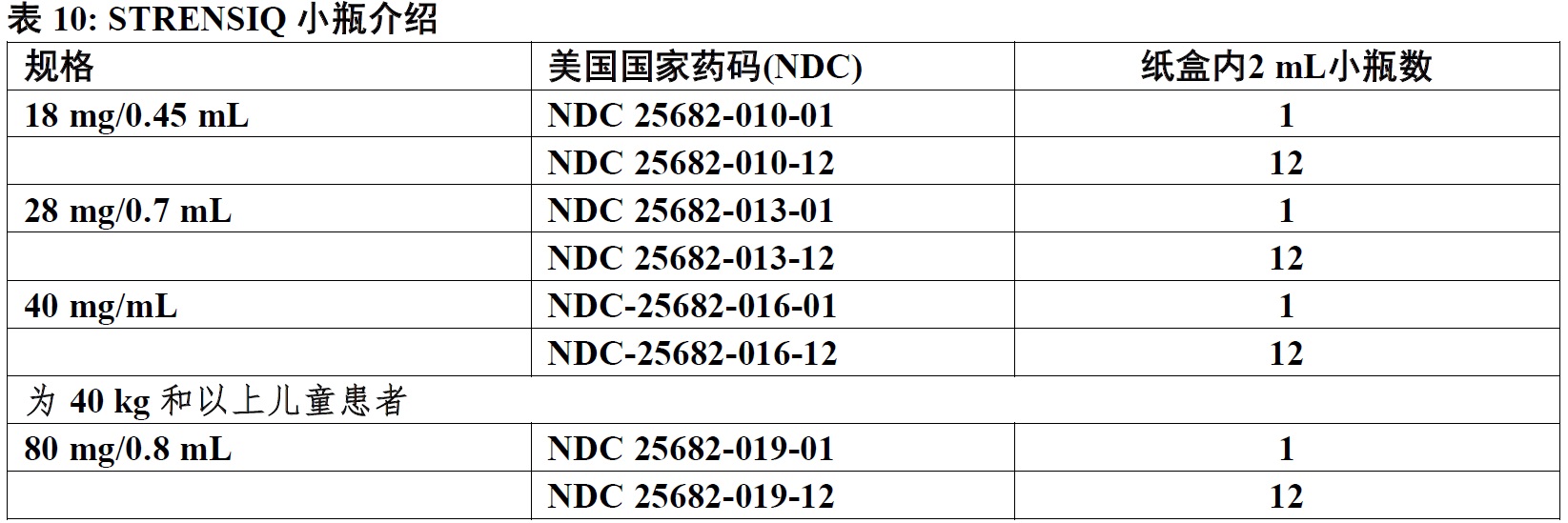
STRENSIQ小瓶用前必须贮存在原始纸盒和避光保护在冰箱条件在2°C至8°C(36°F至46°F)。一旦从冰箱取出,STRENSIQ应在1小时内给药。不要使用超过纸盒标志失效期药物。不要冻结或摇晃。小瓶是只为一次性使用。遗弃任何未使用产品。
17 患者咨询资料
忠告患者阅读FDA-批准的患者说明书(患者说明书和使用指导)。忠告患者或护理人员以下:
制备
●当制备一个为注射体积大于1 mL,体积等同地分开至两个注射器间,和两次至少给予。当给予两次注射时,使用分开的两个注射部位。
●观察小瓶中溶液有无颗粒物质和变色。
●组装注射供应。用无菌可遗弃注射器和注射针头给予STRENSIQ。注射器应足够大小体积和合理准确度从小瓶抽吸处方剂量。总是使用新注射器和针。
●为给药,取下小瓶帽盖,无菌地准备小瓶和注射器插入小瓶抽吸处方剂量。
●去除注射器内任何空气泡和证实正确剂量。
给药
●从冰箱取出小瓶后1小时内给予STRENSIQ。
●轮转注射部位以减少脂肪增生和注射部位萎缩的风险。
●在发红,炎症或肿胀区域不要给予注射。
●皮下注射STRENSIQ至确定部位和适当地遗弃针头。
●STRENSIQ小瓶只为一次性使用。遗弃任何未使用产品。
超敏性反应
● STRENSIQ治疗期间和后可能发生与给药和注射相关反应。告知患者超敏性反应的体征和症状,和有体征和症状发生时立即寻求医疗看护。
脂肪代谢障碍
● 曾报道几个月在注射部位脂肪增生(组装肿大和增厚)和局部萎缩(皮肤凹陷)。遵循适当注射技术和轮转注射部位。
低磷酸酯酶(HPP)注册
●已建立一个注册为了更好了解在人群中HPP,和监视和评价STRENSIQ长期治疗效应。应鼓励患者和他们的护理人员参加和忠告他们的参加是志愿的和可能涉及长期随访。对更多信息,访问www.hppregistry.com

