美国FDA批准Ninlaro,新口服药物治疗多发性骨髓瘤
FDA的药品评价和研究中心中血液学和肿瘤产品室主任Richard Pazdur,M.D.说:“当学习到更多有关多发性骨髓瘤的生物学,我们受到有新途径治疗该级别的鼓舞,” “今天的批准是今年被批准为多发性骨髓瘤的第三个药物和提供患者用一种新口服治疗,它减慢疾病进展当其他治疗已失败。” FDA在今年2月批准Farydak(panobinostat)和这个月早些时候批准Darzalex(daratumumab)。优先审评和孤儿药物指定。
http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/208462lbl.pdf
处方资料重点
这些重点不包括安全和有效使用NINLARO所需所有资料。请参阅NINLARO完整处方资料。
NINLARO®(ixazomib)胶囊,为口服使用
美国初次批准:2015
适应证和用途
NINLARO是一个蛋白体抑制剂适用与来那度胺和地塞米松联用为有多发性骨髓瘤患者曽接受至少一种以前治疗的治疗。(1)
剂量和给药方法
⑴ 推荐起始剂量4 mg口服在28-天疗程的第1,8,和15天。(2.1)
⑵ 剂量应被服用食物前至少一小时或后至少2小时。(2.1)
剂型和规格
胶囊:4 mg,3 mg,和2.3 mg(3)
禁忌证
无。(4)
警告和注意事项
⑴ 血小板减少:治疗期间监视血小板计数至少每月和调整,当需要时。(2.2,5.1)
⑵ 胃肠道毒性:对严重腹泻,便秘,恶心,和呕吐,当需要时调整给药。(2.2,5.2)
⑶ 外周神经病变:监视患者外周神经病变的症状和调整给药,当需要时。(2.2,5.3)
⑷ 外周水肿:监视液体潴留。研究潜在原因,当适当。调整给药,当需要时。(2.2,5.4)
⑸ 皮肤反应:监视患者皮疹和调整给药,当需要时。(2.2,5.5)
⑹ 肝毒性:治疗期间监视肝酶。(5.6)
⑺ 胚胎胎儿毒性:NINLARO可能致胎儿危害。忠告生殖潜能女性和使用有效避孕。
不良反应
最常见不良反应(≥ 20%)是腹泻,便秘,血小板减少,外周神经病变,恶心,外周水肿,呕吐,和背痛。(6.1)
报告怀疑不良反应,联系美国Takeda Pharmaceuticals有限公司电话1-844-617-6468或FDA电话1-800-FDA1088或www.fda.gov/medwatch。
药物相互作用
强CYP3A诱导剂:避免与NINLARO同时使用。(7.1,12.3)
特殊人群中使用
⑴ 肝受损:在有中度或严重肝受损患者减低NINLARO开始剂量至3 mg。(2.3,8.6)
⑵ 肾受损:有严重肾受损或肾病终末期需要透析患者减低NINLARO开始剂量至3 mg。(2.4,8.7)
⑶ 哺乳:终止哺乳。(8.2)
完整处方资料
1 适应证和用途
NINLARO是适用与来那度胺和地塞米松联用为有多发性骨髓瘤曽接受至少一次以前治疗患者的治疗。
2 剂量和给药方法
2.1 给药和给药指导
NINLARO与来那度胺和地塞米松联用
NINLARO的推荐起始剂量是4 mg给予口服一周1次在28-天疗程第1,8,和15天。.
来那度胺的推荐起始剂量是25 mg给予每天28-天治疗疗程第1天至21天。
地塞米松的推荐起始剂量是40 mg给予在28-天治疗疗程的第1,8,15,和22天。
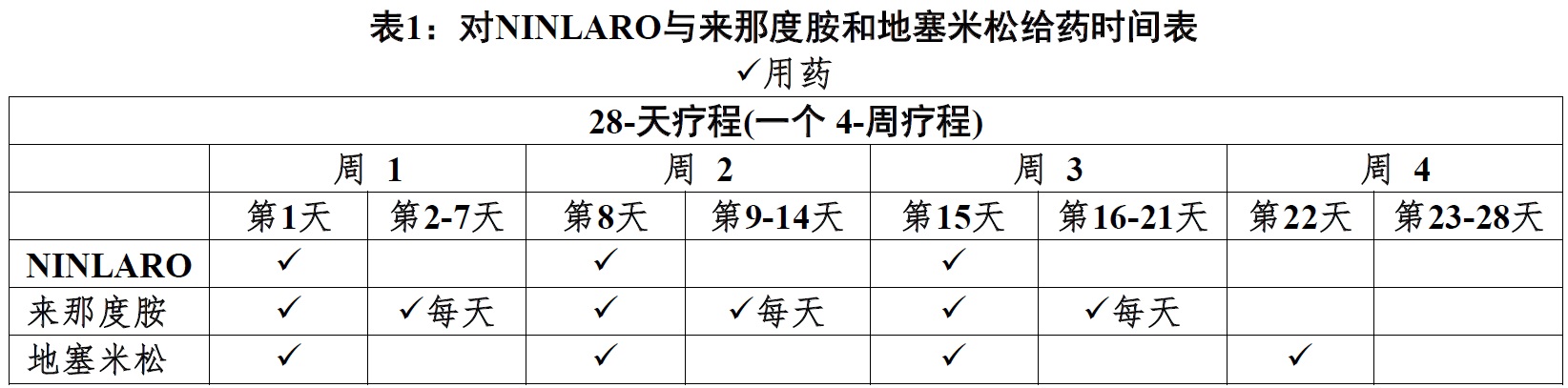
对关于来那度胺和地塞米松另外资料,参阅它们的处方资料。
NINLARO应被服用一周1次对第一个四周疗程的头三周的相同天和在接近相同时间。NINLARO应在食物前至少1小时或后至少2小时服用[见临床药理学(12.3)]。应与水整吞胶囊。胶囊不应被压碎,咀嚼或打开[见如何供应/贮存和处置(16.3)]。
如一次NINLARO剂量被延迟或缺失,只有如时间表下一次是 ≥ 72 小时外才应服用该剂量。在下一次时间表剂量72小时内不应服用一个缺失剂量。对缺失剂量不应服用双重剂量组成。
如果服用一剂后发生呕吐,患者不应重复该剂量。患者应在下一个时间表剂量时恢复给药。
开始一个新治疗疗程前:
● 绝对中性粒细胞计数应是至少1,000/mm3
● 血小板计数应是至少75,000/mm3
● 非血液学毒性应在医生分辨,一般地恢复至患者的基线条件或1级或以下治疗应被继续直至 疾病 进展或不可接受毒性。
2.2 剂量调整指导
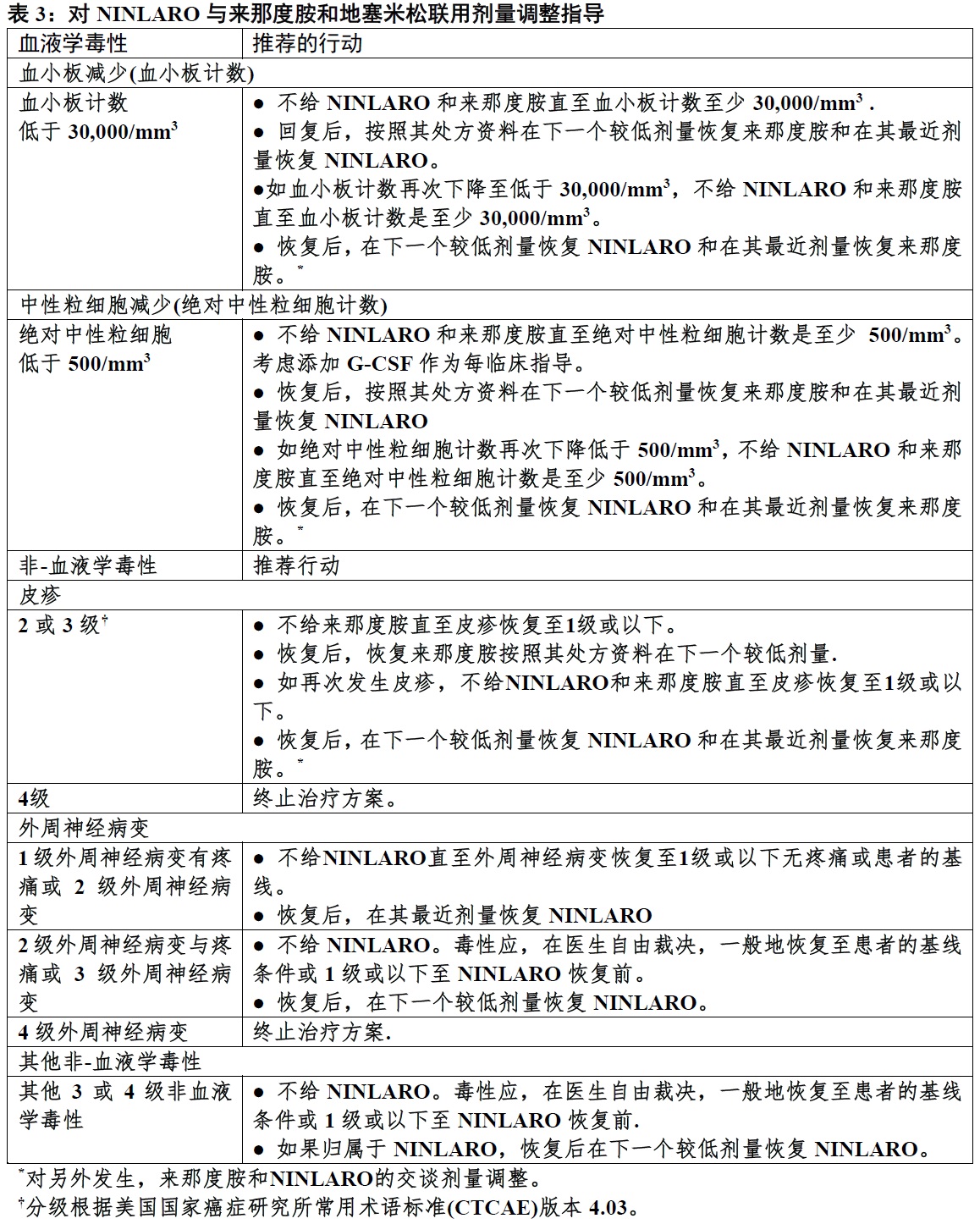
在表2中展示NINLARO剂量减低步骤和表3中提供剂量调整指导。

对NINLARO和来那度胺对血小板减少,中性粒细胞减少,和皮疹如表3中描述推荐一个交替的剂量调整方法。对来那度胺如需要减低剂量参阅来那度胺处方资料。
2.3 有肝受损患者中剂量
在有中度(总胆红素大于1.5-3 × ULN)或严重(总胆红素大于3 × ULN)肝受损患者减低NINLARO开始剂量至3 mg [见特殊人群中使用(8.6)和临床药理学(12.3)]。
2.4 有肾受损患者中剂量
在有严重肾受损(肌酐清除率低于30 mL/min)或肾病终末期(ESRD)需要透析患者中减低NINLARO开始剂量至3 mg。NINLARO是不能透析的和因此可给予不考虑透析时间[见特殊人群中使用(8.7)和临床药理学(12.3)]。
对在有肾受损患者给药推荐参阅来那度胺处方资料。
3 剂型和规格
可得到以下胶囊强度的NINLARO:
● 4 mg:浅橙色明胶胶囊用嘿墨汁在帽上印有“Takeda”和在提上“4.0 mg”。NINLARO 4 mg胶囊含4 mg的ixazomib等同于5.7 mg的ixazomib柠檬酸盐。
● 3 mg:浅灰色明胶胶囊在帽上用嘿墨汁印有“Takeda”和提上“3.0 mg”。NINLARO 3 mg胶囊含3 mg的ixazomib等同于4.3 mg的ixazomib柠檬酸盐。
● 2.3 mg:浅粉红色明胶胶囊用黑墨汁在帽上印有“Takeda”和在体上“2.3 mg”。NINLARO 2.3 mg胶囊含2.3 mg的ixazomib等同于3.3 mg的ixazomib柠檬酸盐。
4 禁忌证
无。
5 警告和注意事项
5.1 血小板减少
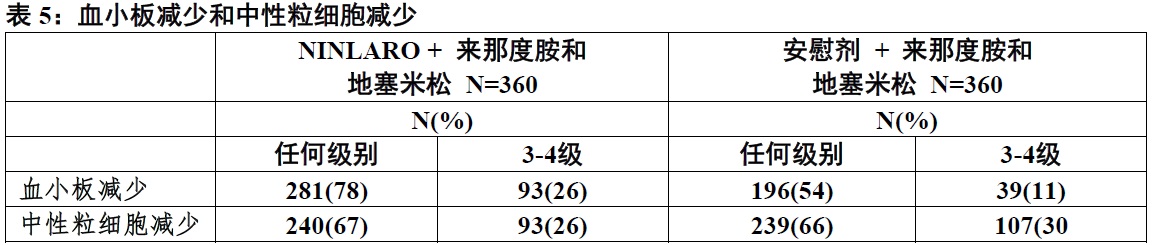
曽报道用NINLARO血小板减少,有血小板最低值典型地发生在每个28-天疗程第14-21天间和至下一个疗程开始恢复至基线。在NINLARO方案中3%患者和在安慰剂方案中1%患者治疗期间有一个血小板计数≤ 10,000/mm3。在两个方案治疗期间都有低于1%患者有一个血小板计数≤ 5000/mm3。两个方案由于血小板减少终止是相似(在NINLARO方案中< 1%患者和在安慰剂方案中2%患者终止三个药物的一个或更多)。在NINLARO方案中血小板输注率为6%和在安慰剂方案中5%。
用NINLARO治疗期间监视血小板计数至少每月。在头三个疗程考虑更频监视。用剂量调整处理血小板减少[见剂量和给药方法(2.2)]和血小板输注作为每个标准医疗指导。
5.2 胃肠道毒性
用NINLARO曽报道腹泻,便秘,恶心,和呕吐,偶然地需要使用抗腹泻药和抗呕吐药,和支持性医护。在NINLARO方案中报道腹泻42%患者和在安慰剂方案中36%,便秘分别34%和25%,恶心分别为26%和21%,和呕吐分别为22%和11%。在NINLARO方案中腹泻导致1% of患者三个药物终止一个或更多和在安慰剂方案中< 1%患者。对 3或4级症状调整给药[见剂量和给药方法(2.2)]。
5.3 外周神经病变
外周神经病变不良反应的多数为1级(在NINLARO方案中18%和在安慰剂方案中14%)和2级(在NINLARO方案中8%和在安慰剂方案中5%)。两个方案报道外周神经病变的3级不良反应 都是2%;没有4级或严重不良反应。
最常报道反应是周边感觉神经病变(在NINLARO和安慰剂方案分别为19%和14%)。在任一方案都不常报道(< 1%)周边运动神经病变。在两个方案中都有1%患者外周神经病变导致终止三个药物的一个或更多。患者应被监视神经病变症状。患者经受新外周神经病变或恶化可能需要剂量调整[见剂量和给药方法(2.2)]。
5.4 外周水肿
在NINLARO和安慰剂方案分别有25%和18%患者报道外周水肿。外周水肿不良反应的多数是1级(在NINLARO方案中16%和在安慰剂方案中13%)和2级(在NINLARO方案中7%和在安慰剂方案中4%)。
在NINLARO和安慰剂方案分别报道在2%和1%患者的3级外周水肿。没有报道4级外周水肿。 没有由于外周水肿终止药物的报道。评价潜在原因和需要时提供支持性医护。对3或4级症状按地塞米松或NINLARO的处方资料调整给药[见剂量和给药方法(2.2)]。
5.5 皮肤反应
在NINLARO方案中19%患者报道皮疹和在安慰剂方案中11%患者。the 皮疹不良反应的多数是1级(在NINLARO方案中10%和在安慰剂方案中7%)或2级(在NINLARO方案中6%和在安慰剂方案中3%)。在NINLARO方案中3%患者报道3级皮疹和在安慰剂方案中1%患者。没有报道皮疹的4级或严重不良反应。在两个方案最常报道的皮疹类型包括斑丘疹和红斑疹。 在两个方案中皮疹导致< 1%患者三个药物的一个或更多终止。如2级或更高用支持性医护或用剂量调整处理皮疹[见剂量和给药方法(2.2)]。
5.6 肝毒性
药物-诱导肝损伤,肝细胞损伤,脂肪肝,淤胆型肝炎和肝毒性各种曽在< 1%用NINLARO治疗患者报道。曽报道肝受损事件(在NINLARO方案中6%和在安慰剂方案中5%)。对3或4级症状监视调节地肝酶和调整给药[见剂量和给药方法(2.2)]。
5.7 胚胎胎儿毒性
当给予至一例妊娠妇女根据作用机制和在动物中发现NINLARO可能致胎儿危害。在妊娠妇女中没有用NINLARO适当和well-对照良好研究。在妊娠大鼠和兔在剂量导致暴露略微较高于在接受推荐剂量患者观察到暴露Ixazomib致胚胎胎儿毒性。
生殖潜能女性应被忠告当正在用NINLARO治疗避免成为妊娠。如妊娠期间被使用NINLARO或如当正在用NINLARO患者成为妊娠,患者应被忠告对胎儿潜在危害。忠告生殖潜能女性用NINLARO治疗期间和最终剂量后共90天她们必须使用有效避孕[见特殊人群中使用(8.1,8.3)和非临床毒理学(13.1)]。
6 不良反应
处方资料的其他节中详细描述以下不良反应:
● 血小板减少[见警告和注意事项(5.1)]
● 胃肠道毒性[见警告和注意事项(5.2)]
● 外周神经病变[见警告和注意事项(5.3)]
● 外周水肿[见警告和注意事项(5.4)]
● 皮肤反应[见警告和注意事项(5.5)]
● 肝毒性[见警告和注意事项(5.6)]
6.1 临床研究经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
来自随机化,双盲,安慰剂-对照临床研究安全性人群包括720患者有复发和/或难治性多发性骨髓瘤,患者接受NINLARO与来那度胺和地塞米松联用(NINLARO方案; N=360)或安慰剂与来那度胺和地塞米松联用(安慰剂方案; N=360)。
在NINLARO方案中最频繁报道不良反应(≥ 20%)和大于安慰剂方案是腹泻,便秘,血小板减少,外周神经病变,恶心,外周水肿,呕吐,和背痛。报道的严重不良反应在≥ 2%患者包括血小板减少(2%)和腹泻(2%)。在NINLARO方案中在≤ 1%患者对各种不良反应,三个药物的一个或多个被终止。
表4总结发生至少5%患者与NINLARO方案和安慰剂方案间至少5%差别不良反应。
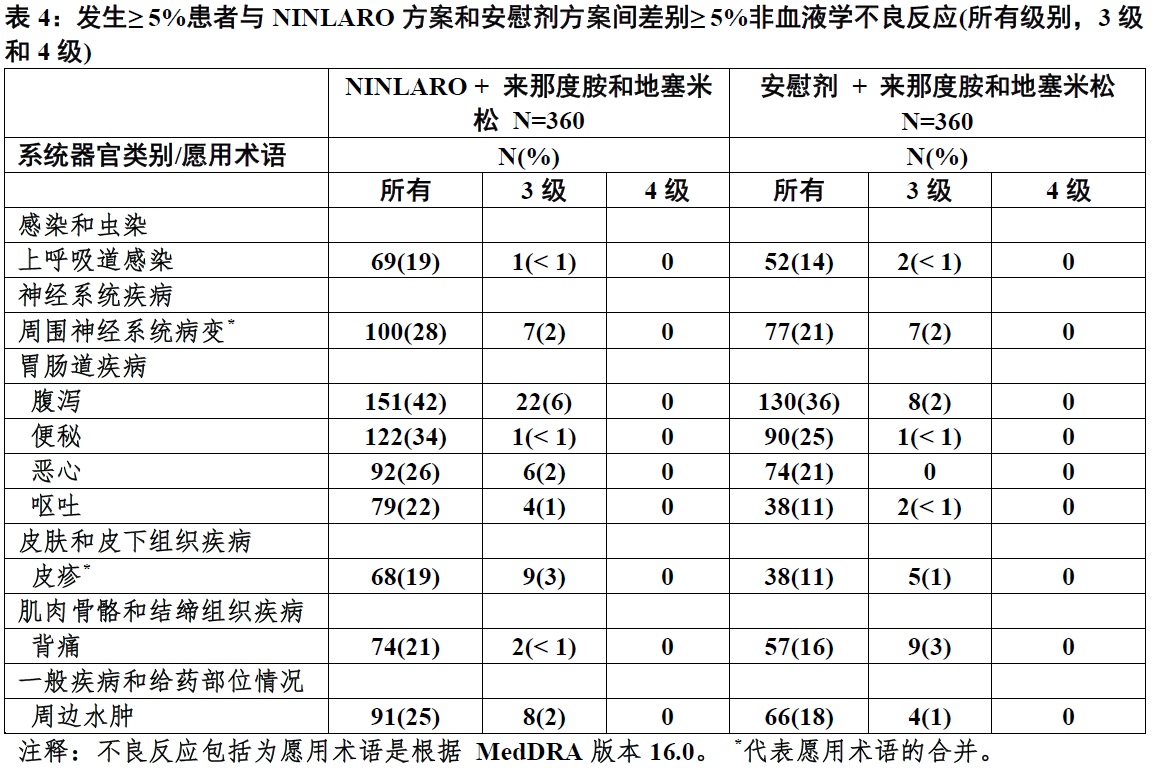
表5代表来自不良事件和实验室数据的合并资料。
眼疾病
眼疾病被报道有许多不同愿用术语但集聚,在NINLARO方案中频数为26%患者和在安慰剂方案中为16%患者。最常见不良反应是视力模糊(在NINLARO方案中6%和在安慰剂方案中3%),干眼(在NINLARO方案中5%和在安慰剂方案中1%),和结膜炎(在NINLARO方案中6%和在安慰剂方案中1%)。在NINLARO方案中2%患者报道3级不良反应和在安慰剂方案中报道1%。
随机化对照试验外报道的不良反应
以下严重不良反应各自曽被报道在频数< 1%:急性发热性嗜中性皮肤病(Sweet氏综合症),Stevens-Johnson综合症,横贯性脊髓炎,脑后部可逆性脑病综合证,肿瘤溶解综合症,和血栓性血小板减少性紫癜。
7 药物相互作用
7.1 强CYP3A 诱导剂
避免NINLARO与强CYP3A诱导剂的共同给药(例如利福平[rifampin],苯妥英[phenytoin],卡马西平[carbamazepine],和圣约翰草[St. John’s Wort])[见临床药理学(12.3)]。
8 特殊人群中使用
8.1 妊娠
当正在用NINLARO治疗时妇女应避免成为妊娠。
风险总结
当给予妊娠妇女NINLARO 可能致胎儿危害。关于NINLARO对妊娠或胚胎或胎儿发育的潜在影响不能到人数据。在妊娠大鼠和兔在剂量导致暴露是略微较高于患者接受推荐剂量暴露观察到暴露Ixazomib致胚胎胎儿毒性[见数据]。忠告妇女对胎儿潜在风险和当正在用NINLARO治疗时避免成为妊娠。
在美国一般人群中,主要出生缺陷和临床上认可妊娠中流产的估算背景风险分别是2-4%和15-20%。
数据
动物数据
在妊娠兔一项胚胎-胎儿发育研究中在剂量也是母体毒性(≥ 0.3 mg/kg)胎儿骨骼变异/异常(尾椎融合,腰椎数,和全编外肋骨)增加。在0.3 mg/kg兔中暴露是在临床在推荐剂量4 mg时平均暴露的1.9倍。在一项大鼠剂量范围-发现胚胎-胎儿发育研究,在0.6 mg/kg在剂量是母体毒性,有胎儿体重减低,胎儿生存力趋向减低,和植入后丢失增加。在大鼠在剂量0.6 mg/kg时暴露是临床时在推荐剂量4 mg平均暴露的2.5倍。
8.2 哺乳
风险总结
不知道NINLARO或其代谢物是否存在于人乳汁中。在人乳汁中存在许多药物和其结果,对哺乳婴儿可能是潜在不良事件。忠告妇女终止哺乳。
8.3 生殖潜能的女性和男性
避孕
生育潜能的男性和女性患者治疗期间和治疗后共90天必须使用有效避孕措施。
不孕不育
未用NINLARO进行生育力研究;但是在大鼠和犬非临床研究中对或雄性或雌性生殖器官没有影响[见非临床毒理学(13.1)]。
8.4 儿童使用
未确定在儿童患者中安全性和有效性。
8.5 老年人使用
NINLARO的临床研究中受试者总数中,55%是65岁和以上,而17%是75岁和以上。这些受试者和较年轻受试者间未观察到安全性或有效性总体差别,和其他报道的临床经验没有确定老年人和较年轻患者间反应差别,但不能除外有些老年个体更大敏感度。
8.6 肝受损
在有中度或严重肝受损患者中,当与正常肝功能患者比较均数AUC增加20%。在有中度或严重肝受损患者中减低NINLARO的开始剂量[见剂量和给药方法(2.3),临床药理学(12.3)]。
8.7 肾受损
在有严重肾受损或ESRD需要透析患者,当与有正常肾功能患者比较均数AUC增加39%。在有严重肾受损或ESRD需要透析患者NINLARO的开始剂量减低。NINLARO是不可透析的和因此无需考虑透析时间给药[见剂量和给药方法(2.4),临床药理学(12.3)]。
10 药物过量
对NINLARO过量没有已知特异性抗毒物。在过量事件中,监视患者不良反应[见不良反应(6.1)]和提供适当支持性医护。
11 一般描述
NINLARO(ixazomib)是一种抗肿瘤药物。Ixazomib柠檬酸盐,一个前药,在生理条件下迅速地水解至它的活性形式,ixazomib。 Ixazomib柠檬酸盐的化学名是 1,3,2-dioxaborolane-4,4-diacetic acid,2-[(1R)-1-[[2-[(2,5dichlorobenzoyl)amino]acetyl]amino]-3-methylbutyl]-5-oxo-和结构式为:
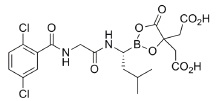
对ixazomib柠檬酸盐分子式为C20H23BCl2N2O9和其分子量为517.12。Ixazomib柠檬酸盐有一个手性中心和是R-立体异构体。Ixazomib柠檬酸盐在0.1N HCl(pH 1.2)在37°C的溶解度是0.61 mg/mL(报道为ixazomib)。溶解度随pH增加而增加。
为口服使用NINLARO(ixazomib)胶囊含4,3或2.3 mg的ixazomib分别等同于5.7,4.3或3.3 mg的ixazomib柠檬酸盐。无活性成分包括微晶纤维素,硬脂酸镁,和滑石。胶囊壳含明教和二氧化钛。4 mg胶囊壳含红和黄色氧化铁,3 mg胶囊壳含黑色氧化铁和2.3 mg胶囊壳含氧化铁红。油墨中含有虫胶,丙二醇,氢氧化钾,和黑色氧化铁。
12 临床药理学
12.1 作用机制
Ixazomib是一种可逆性蛋白体抑制剂。Ixazomib优先结合和抑制胰凝乳蛋白酶-样20S蛋白酶体的β 5亚单位的活性。
Ixazomib在体外诱导多发性骨髓瘤细胞系的凋亡。Ixazomib对来自多种以前治疗后,包括硼替佐米[bortezomib],来那度胺,和地塞米松已复发患者的骨髓瘤细胞显示体外细胞毒性。在多发性骨髓瘤细胞系中Ixazomib和来那度胺的联用显示协同的细胞毒效应。在体内,在一种小鼠多发性骨髓瘤肿瘤异种移植模型ixazomib显示抗肿瘤活性。
12.2 药效动力学
心脏电生理学
根据来自245例患者药代动力学-药效动力学分析数据NINLARO在临床上相关暴露不延长QTc间期。
12.3 药代动力学
吸收
口服给药后,实现达到ixazomib峰血浆浓度中位时间为1小时。根据群体PK分析均数绝对口服生物利用度为58%。跨越剂量范围0.2至10.6 mg Ixazomib AUC以剂量正比例方式增加。
用一个单次4 mg剂量ixazomib在患者中进行食物影响研究显示高-脂肪餐减低ixazomib AUC 28%和Cmax 69%[见剂量和给药方法(2.1)]。
分布
Ixazomib是结合至血浆蛋白99%和分布入红细胞有一个血液-与-血浆比值10。稳态分布容积为 543 L。
消除
根据一项群体PK分析,全身去除率是接近1.9 L/hr有个体间变异性44%。Ixazomib末端半衰期(t1/2)为9.5天。每周口服给药后,被测定积蓄比值是2-倍。
代谢
一个放射性标记剂量口服给药后,血浆中ixazomib代表总药物相关物质的70%。被多种CYP 酶和非-CYP蛋白代谢被期望是对ixazomib的主要清除机制。在临床上相关ixazomib 浓度,在体外研究用人cDNA-表达细胞色素P450同工酶显示无特异性 CYP同工酶对ixazomib 代谢主要地贡献。在较高于临床浓度时,ixazomib被多种CYP 同工酶代谢与估算的相对贡献3A4(42%),1A2(26%),2B6(16%),2C8(6%),2D6(5%),2C19(5%)和2C9(< 1%)。
排泄
在口服给予单剂量14C-ixazomib至5例有晚期癌患者后,在尿中排泄给予放射性的62%和粪中22%。在尿中回收的未变化ixazomib占< 3.5%的给予剂量。
特殊人群
年龄,性别,种族
根据群体PK分析年龄(范围23-91岁),性别,体表面积(范围1.2-2.7 m2),或种族对ixazomib的清除无临床上意义的影响。
肝受损
根据群体PK分析,在有正常肝功能患者和有轻度肝受损患者(总胆红素 ≤ ULN和AST > ULN或总胆红素 > 1-1.5 × ULN和任何AST),ixazomib的PK相似。
在有正常肝功能患者在剂量4 mg(N=12),中度肝受损在剂量2.3 mg(总胆红素 > 1.5-3 × ULN,N=13)或严重肝受损在剂量1.5 mg(总胆红素 > 3 × ULN,N=18)研究ixazomib的PK特征。在有中度或严重肝受损患者与有正常肝功能患者比较,剂量归一化均数AUC较高20% [见剂量和给药方法(2.3)]。
肾受损
根据群体PK分析,在有正常肾功能患者和在有轻度或中度肾受损患者(肌酐清除率 ≥ 30 mL/min),ixazomib的PK相似。
在有正常肾功能(肌酐清除率 ≥ 90 mL/min,N=18),严重肾受损(肌酐清除率 < 30 mL/min,N=14),或ESRD需要透析(N=6)患者中在剂量3 mg条件下研究ixazomib PK的特点。在有严重肾受损或ESRD需要透析患者与有正常肾功能患者比较均数AUC较高39%。测定透析者在血液透析前-和后ixazomib的浓度表明血液透析阶段期间浓度相似,提示ixazomib是不可透析的[见剂量和给药方法(2.4)]。
药物相互作用
其他药物对NINLARO的影响
强CYP3A诱导剂
NINLARO与利福平的共同给药减低ixazomib Cmax 54%和AUC 74% [见药物相互作用(7.1)].
强CYP3A抑制剂
NINLARO与克拉霉素[clarithromycin]的共同给药没有导致ixazomib的全身暴露临床意义变化
强CYP1A2抑制剂
根据一项群体PK分析,NINLARO与强CYP1A2抑制剂共同给药没有导致ixazomib的全身暴露临床意义变化。
NINLARO对其他药物的影响
Ixazomib不是CYPs 1A2,2B6,2C8,2C9,2C19,2D6,或3A4/5的可逆性也不是时间-依赖性抑制剂。Ixazomib不诱导CYP1A2,CYP2B6,和CYP3A4/5活性或相应免疫反应性蛋白水平。 NINLARO不期望产生通过CYP抑制作用或诱导作用药物-药物相互作用。
基于转运蛋白的相互作用
Ixazomib是P-gp低亲和底物。Ixazomib不是BCRP,MRP2或肝OATPs的底物。 Ixazomib不是P-gp,BCRP,MRP2,OATP1B1,OATP1B3,OCT2,OAT1,OAT3,MATE1,或MATE2-K的抑制剂。NINLARO期望是不引起转运蛋白-介导药物-药物相互作用。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在一个细菌回复突变试验(Ames试验)Ixazomib不是致突变剂。在人外周血淋巴细胞体外致断裂试验Ixazomib被考虑阳性。但是,在体内,在一个小鼠骨髓微核试验ixazomib不是致染色体断裂和在体内小鼠comet试验阴性,在胃和肝。未用ixazomib进行致癌性研究。
在大鼠和兔发育毒性研究在ixazomib母体毒性剂量以下没有显示直接胚胎胎儿毒性。没有用ixazomib进行生育力和早期胚胎发育研究和围产期毒理学研究,但在一般毒理学研究生殖组织评价。在大鼠研究直至6个月时间和在犬中直至9个月时间没有由于ixazomib处理对雄性或雌性生殖器官的影响。
14 临床研究
在一项随机化,双盲,安慰剂-对照,多中心研究在有复发和/或难治性多发性骨髓瘤曾接受至少一个以前线治疗患者中评价NINLARO与来那度胺和地塞米松联用的疗效和安全性。研究排除对来那度胺或蛋白体抑制剂难治性患者。
总共722例患者以一个1:1比例被随机化接受或NINLARO,来那度胺和地塞米松(N=360; NINLARO方案)联用或安慰剂,来那度胺和地塞米松联用(N=362; 安慰剂方案)直至疾病进展或不可接受毒性。按以前治疗的线数(1相比2或3),骨髓瘤国际分期系统(ISS)( I或II相比较 III期),和用一种蛋白体抑制剂以前治疗(暴露过或未暴露过)分层随机化。患者的23%(N=166) 有轻链疾病和12%(N=87)患者只有可测量的游离轻链[free light chain-measurable]疾病。
按照来那度胺处方资料在两个治疗组对所有患者建议预防血栓。在NINLARO方案19%患者使用抗吐药和安慰剂方案为12%患者;抗病毒药分别为64%和60%,和抗组织胺分别为27%和19%。这些药物被给予患者在医生的决定作为预防和/或处理症状。
在28-天疗程的第1,8,和15天患者接受NINLARO 4 mg或安慰剂在第1至第21天加来那度胺(25 mg)和在第1,8,15,和22天地塞米松(40 mg)。有肾受损患者按照其处方资料接受一个开始剂量的来那度胺。继续治疗直至疾病进展或不可接受的毒性。
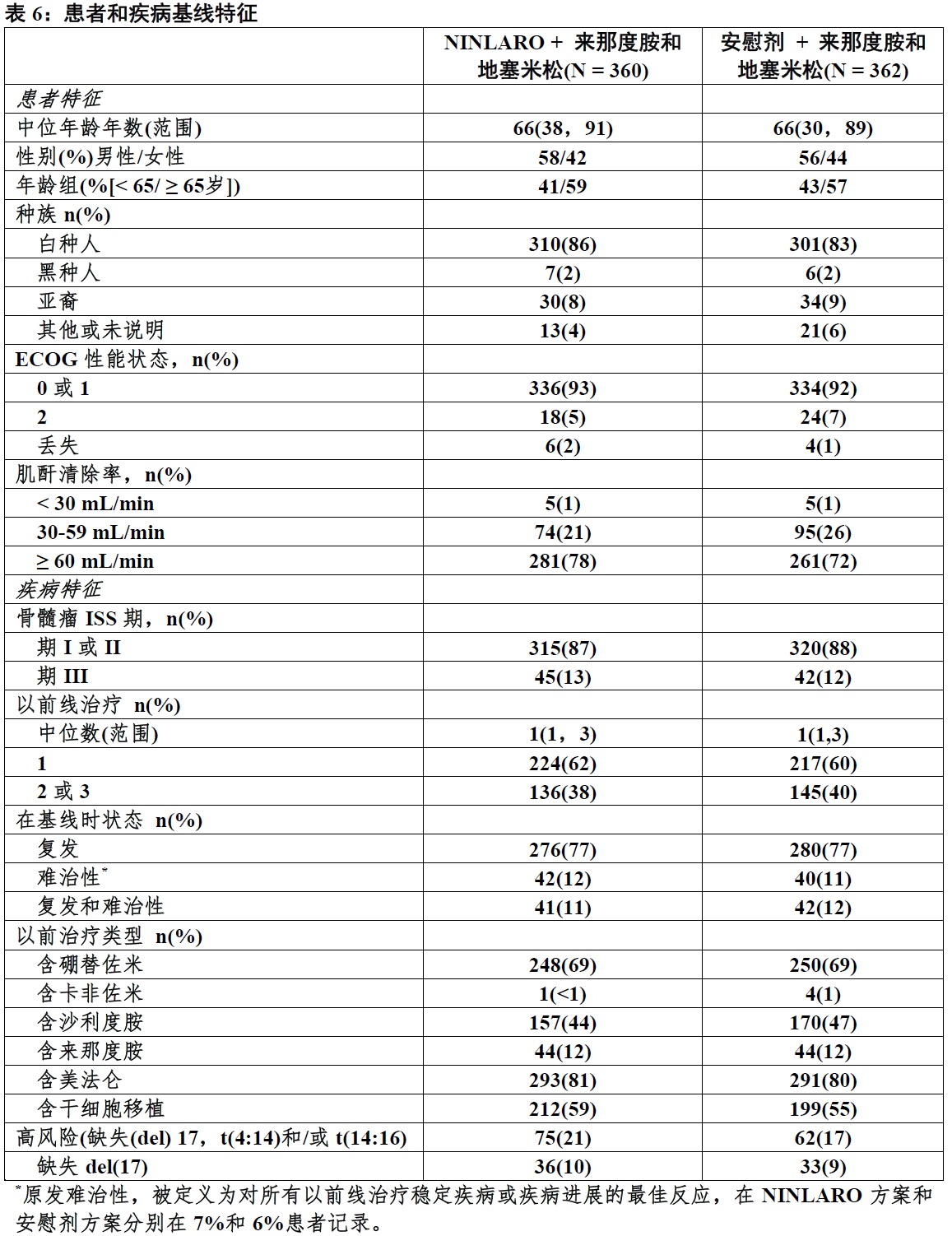
表6 总结在研究中患者和疾病基线特征。基线人口统计指标和疾病特征被平衡和研究方案间有可比性。
用无进展生存(PFS)按照2011年国际骨髓瘤工作组(IMWG)共识统一的反应标准由一个盲态独立评审委员会 (IRC)根据中央实验室结果评估评价NINLARO的疗效。每四周评估反应直至疾病进展。
NINLARO的批准是根据NINLARO方案与安慰剂方案的PFS比较统计学显著改善。在表7中总结PFS结果和显示在图1中。
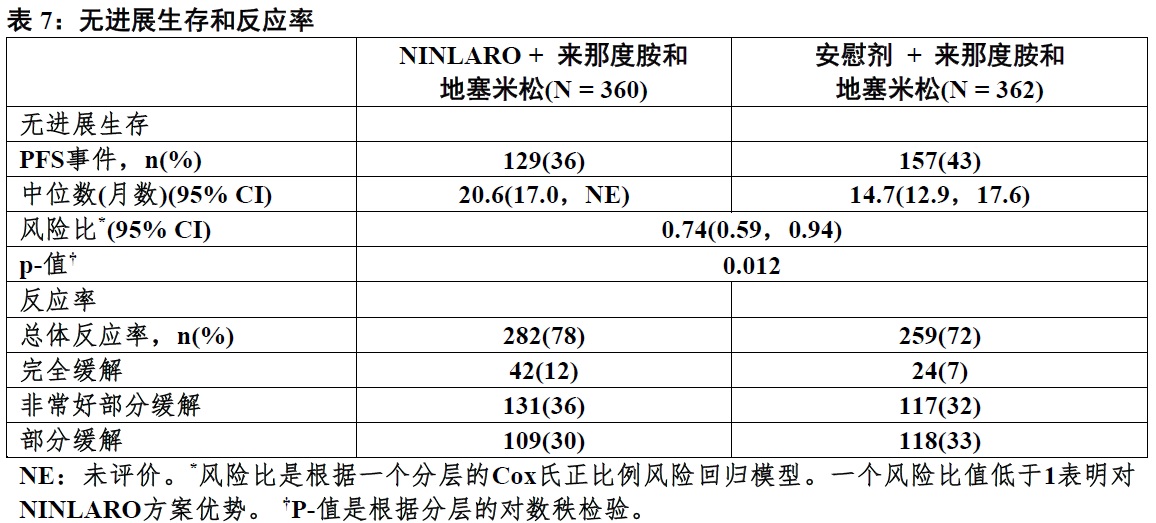
在可评价人群中对反应者,在NINLARO方案至反应中位时间为1.1个月和在安慰剂方案为1.9个月。在NINLARO方案中位反应时间为20.5个月和在安慰剂方案15个月。
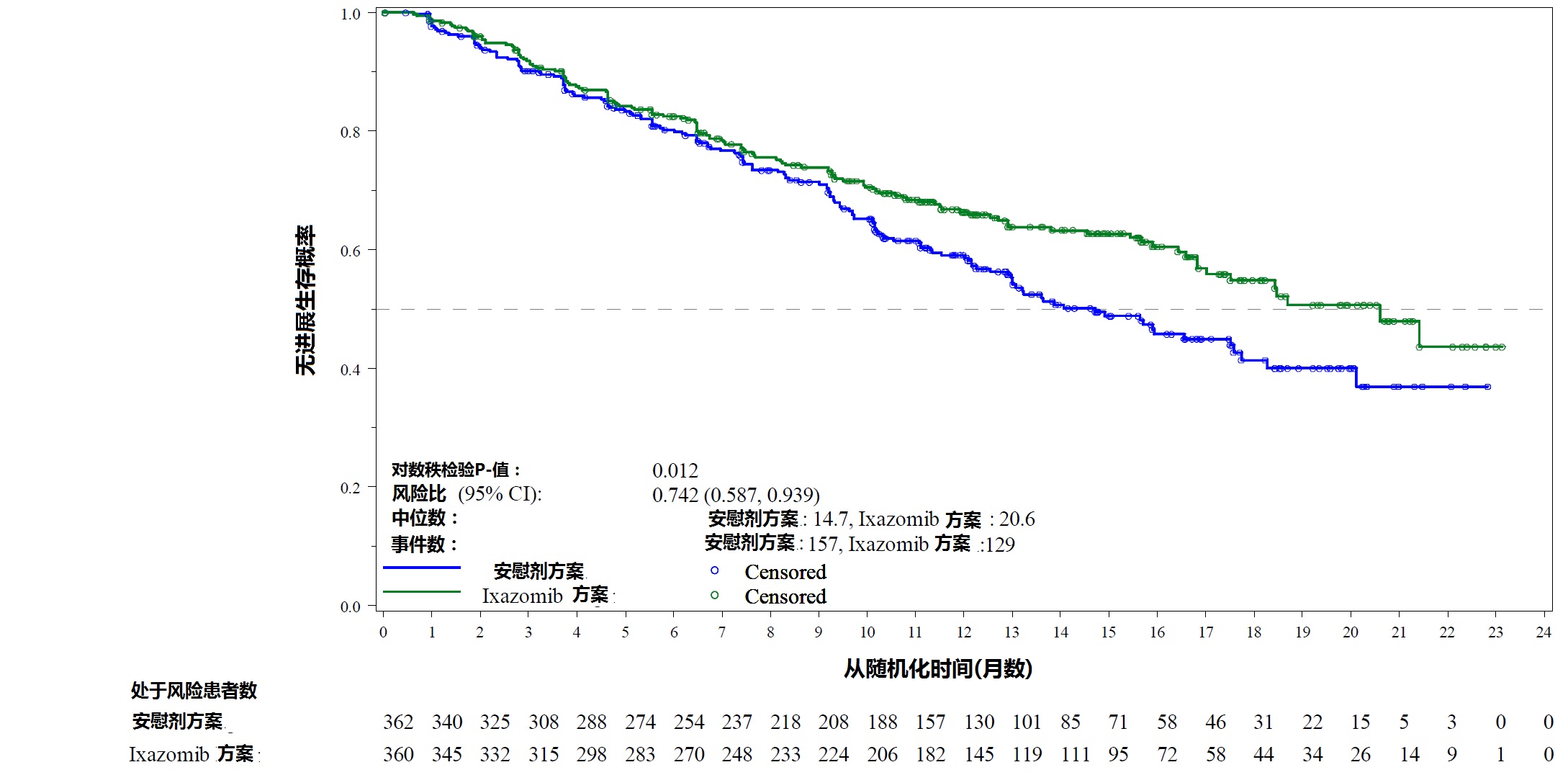
图1:无进展生存Kaplan-Meier作图。
在中位随访至23个月有372 PFS事件时进行一个非推理PFS分析。对NINLARO方案相比较安慰剂方案风险比为0.82(95%可信区间[0.67,1.0]),和在NINLARO方案估算中位PFS为20个月和在安慰剂方案为15.9个月。在相同时间,进行一个计划的OS分析对最终OS分析需要死亡数有35%;在NINLARO方案有81例死亡和在安慰剂方案90例死亡。没有证实一个总生存OS获益。
15 参考资料
1. OSHA Hazardous Drugs. OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html
16 如何供应/贮存和处置
16.1 如何供应
NINLARO被供应如下:
4 mg明胶胶囊:浅橙色,大小3,用黑墨汁在帽上印有“Takeda”和体上“4.0 mg”。NINLARO 4 mg胶囊含4 mg的ixazomib等同于5.7 mg的ixazomib柠檬酸盐。
● 一粒4 mg胶囊在一个单吸塑包装(NDC 63020-080-01)
● 三粒4 mg单吸塑包装在一个纸盒(NDC 63020-080-02)
3.0 mg明胶胶囊:浅灰色,大小4,用黑墨汁在帽上印有“Takeda” 和仔体上“3.0 mg”。NINLARO 3 mg胶囊含3 mg的ixazomib等同于4.3 mg的ixazomib柠檬酸盐。
● 一粒3 mg胶囊在一个单吸塑包装(NDC 63020-079-01)
● 三粒 3 mg单包装在纸盒内(NDC 63020-079-02)
2.3 mg明胶胶囊:浅粉红色,大小4,用黑墨汁在帽上印有“Takeda”和在体上“2.3 mg”。 NINLARO 2.3 mg胶囊含2.3 mg ixazomib等同于3.3 mg ixazomib柠檬酸盐。
● 一粒2.3 mg胶囊在一个单吸塑包装(NDC 63020-078-01)
● 三粒2.3 mg单包装在一纸盒包装(NDC 63020-078-02)胶囊被各个包装在一个PVC-铝/铝泡罩。
16.2 贮存
NINLARO 可能被贮藏在室温。不要高于30°C(86°F)。不要冻结。贮藏胶囊在原始包装直至直至用前立即。
16.3 处置和遗弃
NINLARO是细胞毒性1。胶囊不应被打开或压碎。应避免直接接触胶囊内容物。在胶囊破裂情况中,避免胶囊内容物与皮肤或眼直接接触。如发生与皮肤接触,用肥皂和水彻底洗涤。如发生与眼接触,用水彻底地冲洗。
任何未使用药物产品或废料应按照当地要求遗弃。
17 患者咨询资料
忠告患者阅读FDA-批准的患者说明书(患者资料)。
给药指导
● 指导患者服用NINLARO准确地如处方。
● 忠告患者服用NINLARO 一周1次在相同天和对四周疗程的头三周在接近相同时间。
● 忠告患者服用NINLARO在食物前至少1小时或食物后至少2小时。
● 忠告患者NINLARO和地塞米松不应在相同时间用,因为地塞米松应与食物服用和NINLARO不应予食物服用。
● 忠告患者用水整吞胶囊。胶囊不应被压碎,咀嚼或打开。
● 忠告患者应避免直接与接触胶囊内容物。在胶囊破裂情况中,避免胶囊内容物与皮肤或眼接触。如与皮肤接触,用肥皂和水彻底洗涤。如与眼接触,用水彻底冲洗。
● 如患者缺失一剂,忠告他们服用缺失剂量长达下一次时间表剂量是≥ 72小时外。忠告患者不要服用如缺失剂量在它们下一个时间表剂量72小时内。
● 如患者服用一剂后呕吐,忠告他们不要重复该剂但在下一个时间表剂量恢复给药。
● 忠告患者贮存胶囊在原始包装,和不要从包装取出胶囊直至服用NINLARO前。[见剂量和给药方法(2.1)]
血小板减少
忠告患者他们可能经历低血小板计数。血小板减少的征象可能包括出血和易瘀伤。[见警告和注意事项(5.1)].
胃肠道毒性
忠告患者他们可能经历腹泻,便秘,恶心和呕吐和如这些不良反应持续联系他们的医生。[见警告和注意事项(5.2)].
外周神经病变
忠告患者如他们经受新或外周神经病变症状恶化例如发麻刺痛,麻木,疼痛,手足烧灼感,或臂或腿软弱联系他们的医生。[见警告和注意事项(5.3)].
外周水肿
忠告患者如他们经受他们肢体不寻常肿胀或由于肿胀体重增量联系他们的医生[见警告和注意事项(5.4)]。
皮肤反应
忠告患者如他们经受新或恶化皮疹联系他们的医生[见警告和注意事项(5.5)]。
肝毒性
忠告患者如他们经受黄疸或右上象限腹痛联系他们的医生[见警告和注意事项(5.6)]。
妊娠
忠告妇女对胎儿潜在风险和当正在被用NINLARO治疗和最后剂量后共90天避免成为妊娠。忠告患者立即联系他们的医生如她们或他们的女性伴侣成为妊娠治疗期间或最后剂量90天内[见警告和注意事项(5.7)]。
同时药物
忠告患者与她们的医生说关于她们当前正在用的任何其他药物和任何新药开始前。

